稳定性研究在制药行业中扮演着重要角色。药品产品的稳定性研究有所有的指导方针,如国际协调会(ICH)、美国食品和药物管理局(USFDA)、欧洲药品管理局(EMEA)、世界卫生组织(WHO)等。存放时限研究数据应该确保中间产品/待包装产品的最大允许存放时限。
存放时限研究样品需要使用常用的聚乙烯袋、消毒容器、高密度聚乙烯(HDPE)或玻璃容器包装。样品需要存放在GMP条件下,即在制造区域的批次或阶段保持。
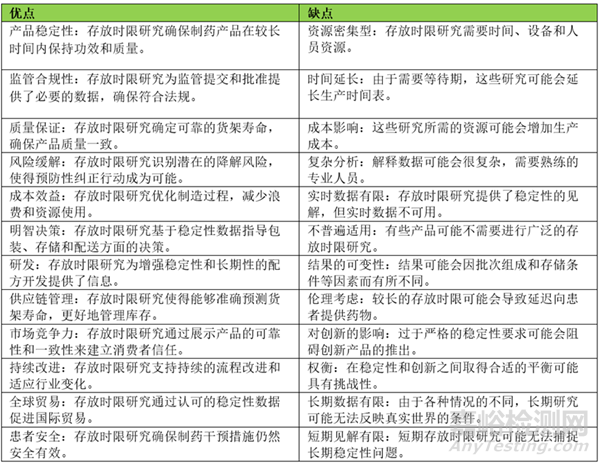
存放时限研究在制药行业中的优点和缺点
存放时限研究是指在制药行业进行的一系列受控实验,旨在评估产品在一定时间范围内的稳定性和可行性。这些研究在确保产品完整性、监管合规性、优化生产流程、风险缓解、质量控制、明智决策、研发、供应链管理、市场竞争力、持续改进、全球覆盖和创新信心方面发挥着关键作用。
存放时限稳定性研究流程
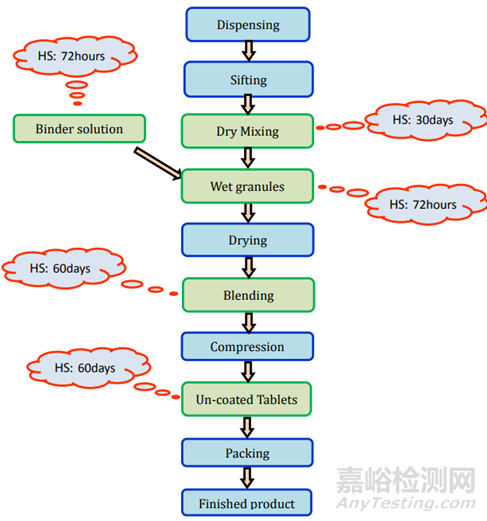
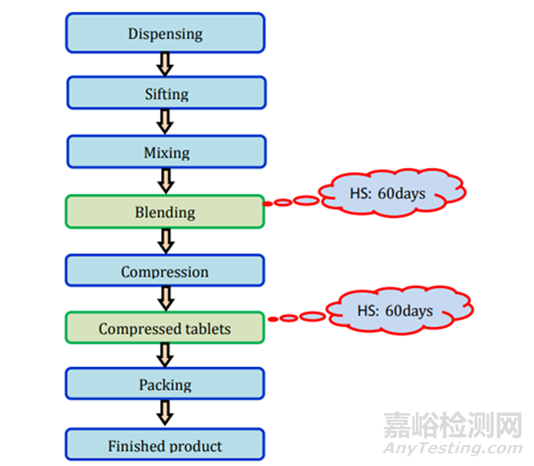
图1存放时限研究流程图
存放时限研究在产品开发阶段、放大阶段和商业验证阶段进行。在开始存放时限研究之前,制剂科学家需要选择关键阶段、时间点和测试项目。流程如图1所示。可按照以下步骤进行:
i.选择关键步骤;
ii.保持研究时间点和测试;
iii.保持研究方案;
iv.保持研究分析;
v.保持研究报告;
vi.保持研究结果评估。
依照剂型制定的研究阶段
主要的存放时限研究阶段包括混合、搅拌、润滑、粘合剂溶液、包衣溶液、未包衣片剂、包衣片剂、填充胶囊、糖浆溶液、注射用粉末、液体注射剂、散装乳霜/软膏/凝胶。
选择存放时限稳定性研究条件非常重要。这些条件与制造区域/存放区域的条件相同,根据剂型的制造工艺,可以确定存放时限稳定性研究阶段。表1总结了所有制药剂型的存放时限研究阶段和研究时间要求。
表1 不同剂型及制剂阶段存放时限研究汇总
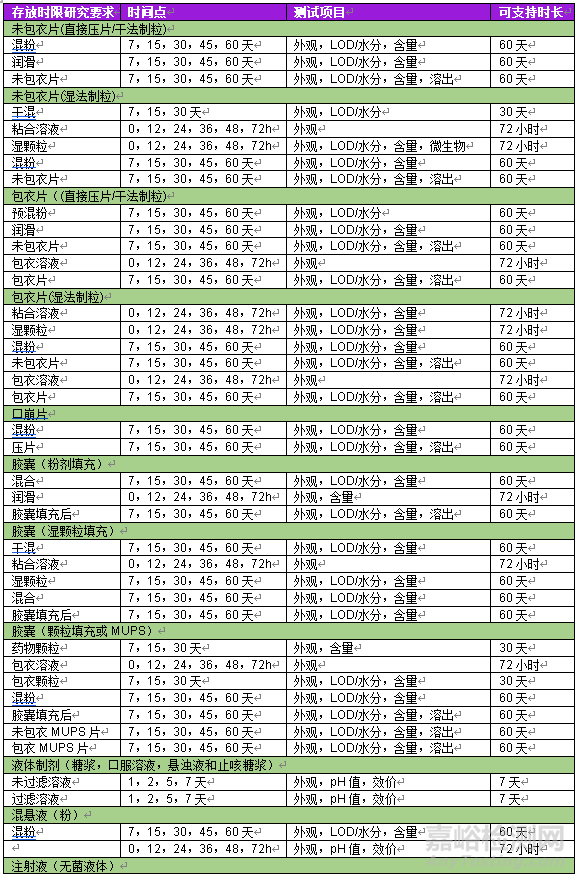
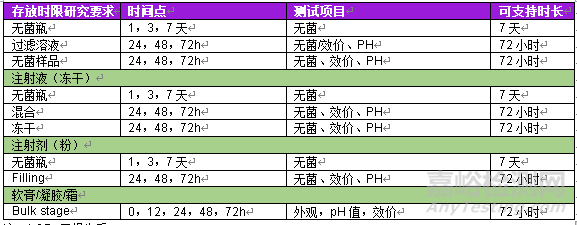
注:LOD=干燥失重
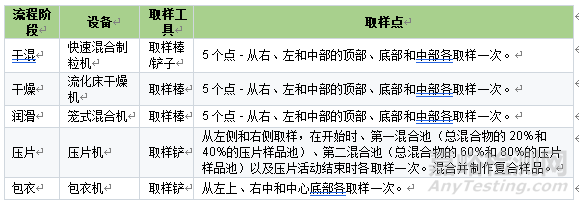
表1 不同制剂阶段推荐取样方式
1. 片剂
通常,片剂有两种类型,即未包衣片剂和包衣片剂(薄膜包衣或肠溶包衣)。
1.1. 未包衣片剂
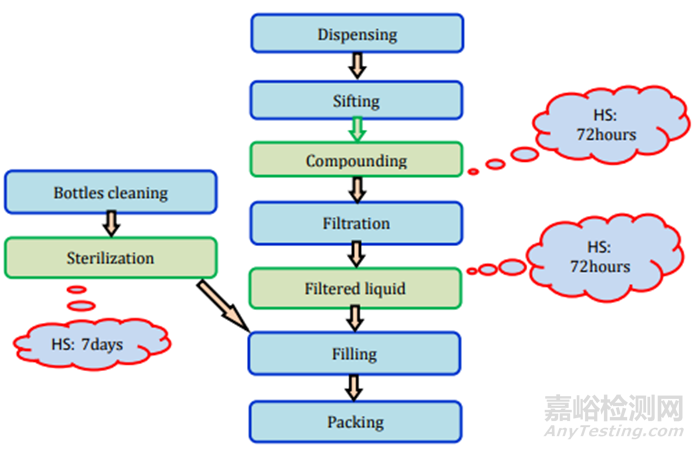
未包衣片剂采用直接压片法和湿法造粒法制造。直接压片法是制造片剂的简单和成本效益的方法,因为它需要的加工阶段比湿法造粒和辊压成型等其他技术少。大多数API(活性药物成分)由于缺乏流动性、和润滑性,无法直接压制成所需的片剂。
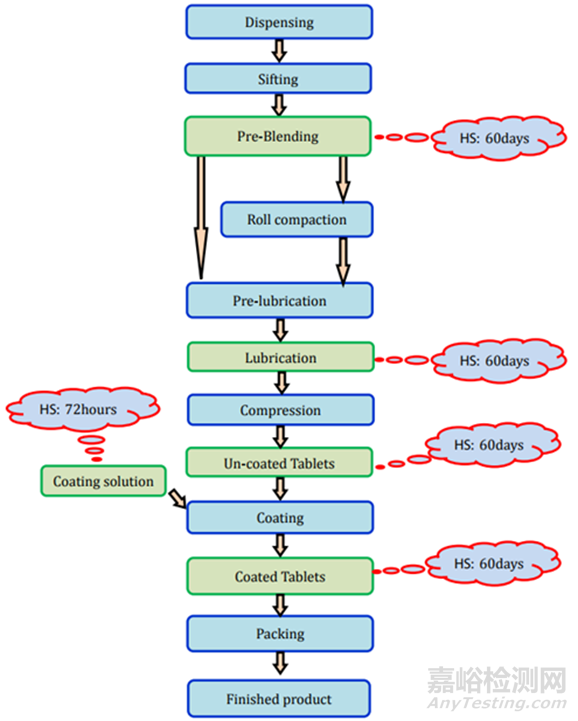
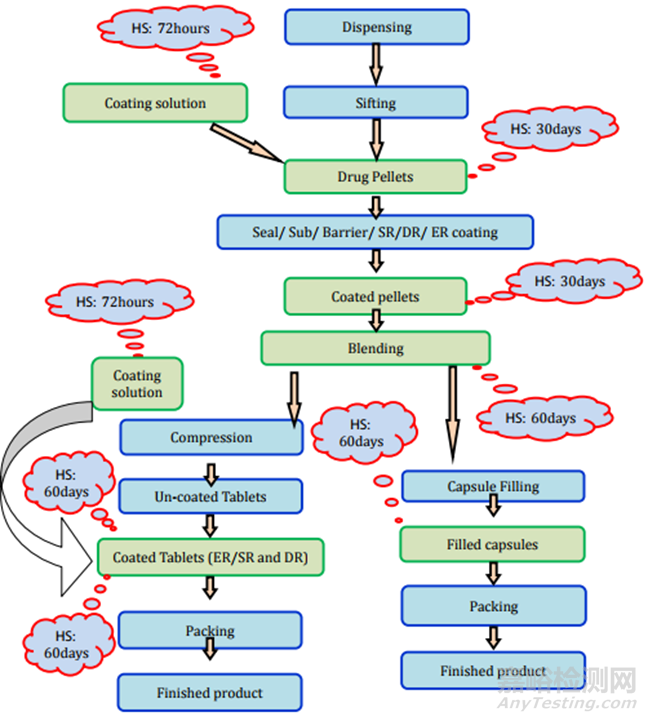
直接压片/干法制粒:所需的测试和时间点列在表2中,存放时限研究的要求见图2。
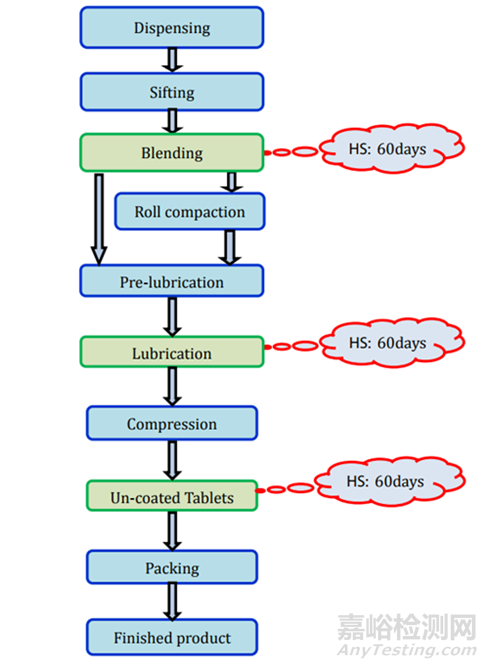
图2未包衣片(直接压片/干法制粒)制剂过程及存放时限研究要求
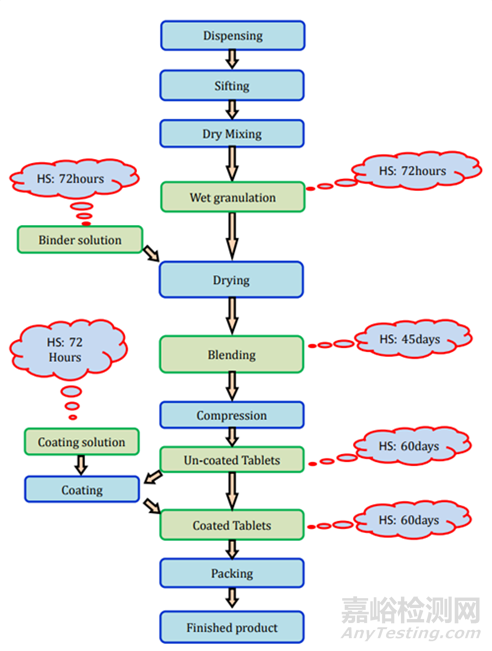
湿法制粒:制造工艺的详细信息和存放时限研究细节在图3和表2中表示。
图3未包衣片(湿颗粒)制剂过程及存放时限研究要求
1.2. 包衣片
这类片剂也可以通过直接压片/干法造粒和湿法造粒工艺制造。直接压片/干法造粒方法的片剂制造过程和存放时限稳定性要求见图3。湿法造粒制造过程和存放时限研究要求见图4。
图4包衣片(湿颗粒)制剂过程及存放时限研究要求
2. 可分散片剂/口崩片
可分散片剂通常在给药给患者之前在水或其他液体中分散。这种药物产品适用于吞咽固体剂型(如片剂或胶囊)存在困难的患者。制造过程和存放时限研究要求见表2和图2~6。
图5包衣片(直接压片/干法制粒)制剂过程及存放时限研究要求
图6可分散片剂/口崩片制剂过程及存放时限研究要求
3. 胶囊
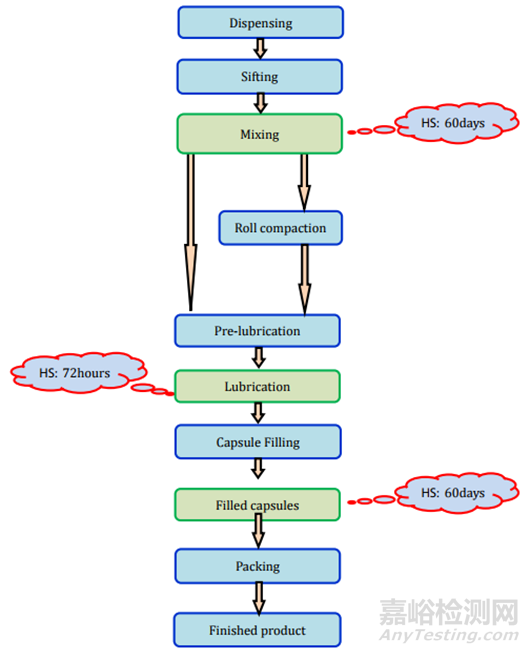
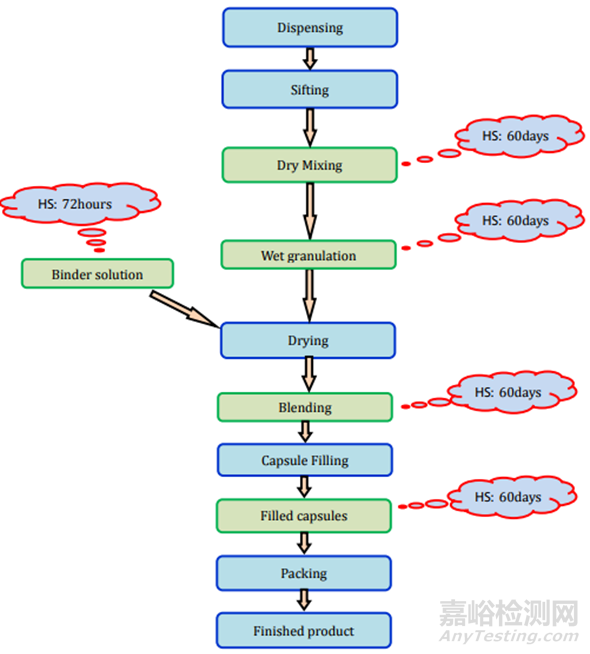
胶囊可以填充粉末、颗粒、微粒、片剂、迷你片剂等。主要有两种类型的胶囊:1.硬壳胶囊,通常用于干燥的粉末成分或微小颗粒;2.软壳胶囊,主要用于油和溶解或悬浮在油中的活性成分。所有类型胶囊的制造过程和存放时限研究要求见表2和图7-9。
图7胶囊(粉剂填充)制剂过程及存放时限研究要求
图8胶囊(湿颗粒)制剂过程及存放时限研究要求
图9胶囊(颗粒/MUPS)制剂过程及存放时限研究要求
4. 混悬剂
混悬剂是不溶性或溶解性差的药物在各种治疗应用中的首选和广泛接受的剂型。混悬剂长期以来一直被用于制备口服、局部和肠道制剂中的不溶性和溶解性差的药物。
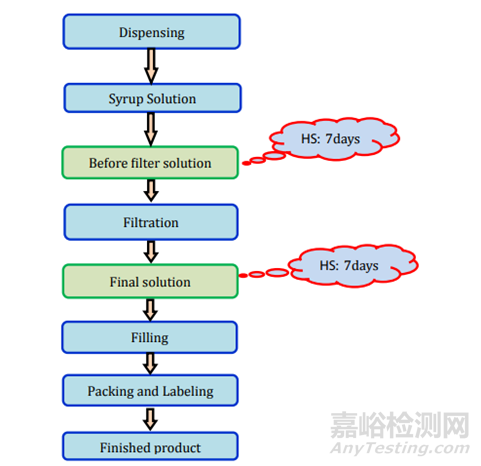
图10-16中表示了适当的分析方法和仪器(色谱仪、粘度计、粒径分析仪等)必须使用来正确表征混悬剂配方。
图10液体制剂过程及存放时限研究要求
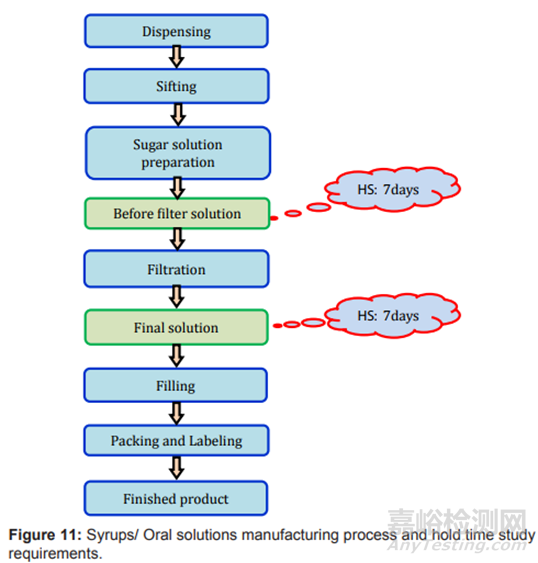
图11制剂过程及存放时限研究要求
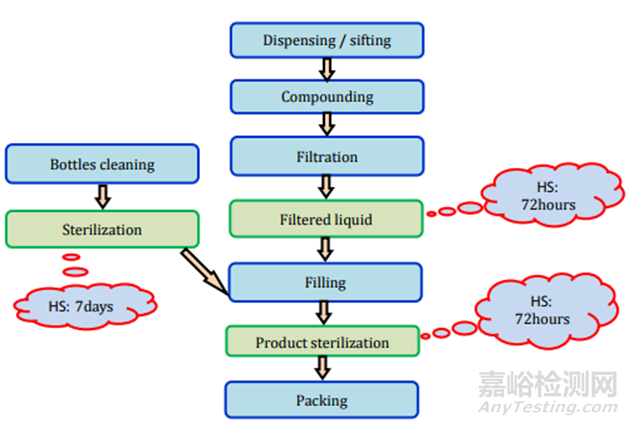
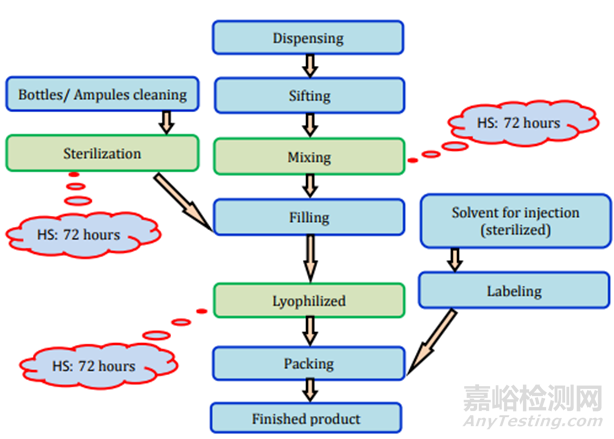
图12注射(无菌液体)制剂过程及存放时限研究要求
图13注射(液体)制剂过程及存放时限研究要求
图14注射(粉末)制剂过程及存放时限研究要求
图15注射(冻干)制剂过程及存放时限研究要求
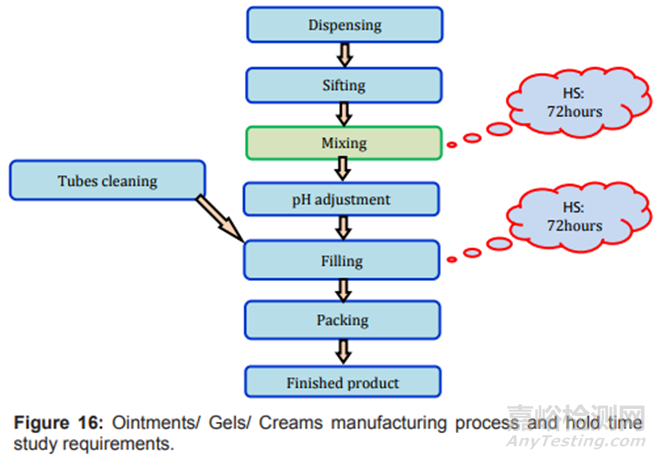
图16制剂过程及存放时限研究要求
存放时限研究提供了每个在生产过程阶段的质量再保证。存放时限稳定性研究是每个药品制造阶段的稳定性建立工具。在药品产品开发中,存放时限稳定性是建立在制存放时限的重要工具。存放时限稳定性是评估产品制造中每个阶段的。保持稳定性研究可以展示混合或散装阶段在进行下一个阶段加工之前适合保持多长时间。在适当的情况下,应该建立每个生产阶段完成的时间限制,以确保药品产品的质量。存放时限稳定性研究结果应该符合产品质量标准。存放时限研究应该只进行存储容器的包装。如果剂型在散装容器中存放超过30天,应该在指定条件下生成实时稳定性数据,以证明与市场包装中的剂型具有可比性的稳定性。
建议和结论
保持研究评估在GMP条件下制造新产品起着重要作用。基于存放时限研究的建立和货架寿命,可以制定产品的生产计划。
参考资料
[1]https://www.linkedin.com/pulse/hold-time-study-shouvik-mondal
[2]Useni Reddy Mallu*, Arunkanth Krishnakumar Nair, Sridhar Bandaru and Jonna Sankaraiah, Hold Time Stability Studies in Pharmaceutical Industry: Review
[3]Huma Ali1*, Abdul Majid Khatri1, Ashish Jain1, Ravi Modi1, Alpesh Patel1, Standard Practice of sampling, storage and Holding Time for Pharmaceutical Tablet and Injection during manufacturing process
[4]WHO TRS 992 “Annex 4 General guidance on hold-time studies”
[5] Hold time study in Pharma 2023