今日头条
博安长效GLP-1R降糖III期临床积极。绿叶制药旗下博安生物宣布其自主研发的生物类似药度拉糖肽注射液(BA5101)已在中国2型糖尿病患者的III期临床达到所有预设终点,BA5101与原研产品度易达®(Trulicity®,礼来)在降低血糖和糖化血红蛋白方面的疗效和安全性一致,即将递交上市申请。在海外,博安生物已启动BA5101的临床和注册工作。
国内药讯
1.泽布替尼获FDA批准新适应症。百济神州BTK抑制剂泽布替尼(百悦泽)获FDA批准第5项适应症,联合CD20单抗奥妥珠单抗治疗既往至少经过二线治疗后复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。在II期ROSEWOOD研究中,与奥妥珠单抗单药相比,泽布替尼联合治疗提高了患者总缓解率(69.0%vs45.8%,p=0.0012)。去年11月,欧盟已批准泽布替尼用于治疗R/R FL的上市申请。
2.维昇引进长效生长激素报产。维昇药业从Ascendis Pharma公司引进的长效生长激素隆培促生长素(lonapegsomatropin)的上市申请获CDE受理,拟每周注射一次用于治疗儿童生长激素缺乏症(GHD)。在关键III期临床中,与生长激素日制剂相比,隆培促生长素治疗52周后患者的年化生长速率达到非劣效性标准(10.66cm/年对比9.75cm/年)。维昇药业拥有隆培促生长素在大中华区的独家开发、生产和商业化权利。
3.上海民为减肥激动剂启动II期临床。民为生物GLP-1/GCG/GIP-Fc融合蛋白MWN101登记启动一项II期临床,拟评估用于非糖尿病的超重或肥胖受试者中的有效性、安全性及药代动力学特征。该项试验由河南科技大学第一附属医院姜宏卫博士牵头开展,主要终点为给药24周后空腹体重较基线的相对变化百分比、不良事件、生命体征、12-导联心电图、体格检查等。
4.再生元补体RNAi新药获批临床。再生元与Alnylam公司开发的C5补体RNAi疗法cemdisiran(ALN-CC5)获国家药监局临床许可,联合新一代C5补体抑制剂pozelimab用于治疗伴有活动性体征和溶血迹象的阵发性夜间血红蛋白尿(PNH)患者。在Ⅲ期临床中,该联合疗法将患者乳酸脱氢酶(LDH)水平降至0.8x正常值上限(ULN),且患者在第8周至第26周期间实现LDH控制的比例较对照组更高(91%vs73%)。
5.强生创新三抗中国获批IND。强生旗下1类新药JNJ-80948543注射液获国家药监局临床许可,拟开发治疗淋巴细胞恶性肿瘤。JNJ-80948543是一款新型CD79b/CD20 /CD3三特异性T细胞重定向抗体。该新药目前处于Ⅰ/Ⅱ期临床开发阶段,正在评估JNJ-80948543用于非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL)受试者,以及JNJ-80948543联合T细胞接合器治疗B细胞NHL受试者的安全性与有效性。
国际药讯
1.O药一线治疗膀胱癌获FDA批准。百时美施贵宝PD-1抑制剂Opdivo获FDA批准新适应症,联合顺铂和吉西他滨一线治疗不可切除或转移性尿路上皮癌(UC)。在III期CheckMate-901试验中,与顺铂化疗方案相比,Opdivo联合用药使患者死亡风险降低22%(中位OS:21.7个月vs18.9个月)。此前,FDA已批准Opdivo用于治疗晚期或转移性UC经治患者,以及成人UC患者的辅助治疗。
2.司美格鲁肽心血管适应症获批上市。诺和诺德宣布司美格鲁肽(2.4mg,商品名Wegovy)获FDA批准新适应症,用于降低心血管疾病合并肥胖或超重成年人发生心血管死亡、心脏病发作和中风风险。在III期SELECT研究中,与安慰剂相比,Wegovy治疗组患者的MACE(心血管死亡、心脏病发作和中风)风险显著降低(6.5%vs8%)。Wegovy也是首款获批用于降低MACE风险的肥胖症治疗药物。
3.TauRx公司AD口服新药Ⅲ期临床成功。TauRx公司口服tau蛋白聚集抑制剂HMTM在AD/PD 2024会议上公布用于治疗早期到中度阿尔茨海默病患者的Ⅲ期LUCIDITY研究积极结果。数据显示,HMTM(16mg)治疗12个月时,患者的血液中神经丝蛋白轻链(NfL)水平的变化较对照组减少95%(p=0.0291);在对照组转换接受HMTM(16mg)治疗的扩展研究中,患者12个月治疗后其ADAS-Cog13评分较基线显著降低(p=0.0308)。
4.GSK骨髓瘤ADC达Ⅲ期临床终点。葛兰素史克靶向BCMA的抗体偶联药物Blenrep(belantamab mafodotin)联合泊马度胺pomalidomide加地塞米松(PomDex)用于二线及以上治疗复发性或难治性多发性骨髓瘤的Ⅲ期DREAMM-8研究达到主要终点。与标准治疗硼替佐米(bortezomib)加PomDex相比,Blenrep组合显著延长了患者的无进展生存期(PFS);总生存期(OS)也显示改善趋势。该项试验结果与另一项Ⅲ期试验DREAMM-7中所观察到Blenrep组合的疗效一致。
5.创新迷幻药获焦虑症突破性疗法认定。Mind公司靶向5-羟色胺2A(5-HT2A)激动剂MM120获FDA授予突破性疗法认定,用于治疗广泛性焦虑症(GAD)。在Ⅱb期临床中,MM120(100微克)单剂治疗第12周时的哈密尔顿焦虑评分量表(HAM-A)评分较安慰剂改善7.7点(-21.9对比-14.2;p<0.003),临床应答率为65%。MM120属于血清素能的迷幻药,MindMed正在开发MM120用于治疗GAD和注意缺陷多动障碍(ADHD)。
6.FDA延迟审查礼来Aβ单抗NDA。FDA延迟审查礼来Aβ单抗Donanemabd用于治疗早期症状性阿尔茨海默病(AD)的上市申请,PDUFA时间由2024年Q1推迟至2024年Q1之后。在III期TRAILBLAZER-ALZ 2研究中,donanemab治疗组患者的iADRS评分和CDR-SB评分的下降速度分别减缓35%和36%,疾病进展速度延缓40%。在中国,该新药已获突破性疗法认定,并被纳入优先审评。
医药热点
1.林天歆任中山大学附属第五医院院长。3月7日,中山大学附属第五医院召开校管干部会议,宣布学校干部任命决定:任命林天歆同志为中山大学附属第五医院院长。林天歆教授长期致力于膀胱癌微创精准诊疗体系建立与推广应用,在人工智能技术开发与应用、尿液无创精准诊断、术前转移风险预测、膀胱癌术式创新、膀胱癌治疗新靶点等方面取得突出的成绩。
2.北京地坛医院开设心脑同治联合门诊。3月7日,北京地坛医院开设的心脑同治联合门诊正式开诊,来自心内科、神经内科、神经外科的专家团队共同为合并心脑血管疾病、心源性脑卒中、晕厥等患者进行多对一联合诊疗,为患者提供更为系统高效的诊疗服务,实现从挂号、检查、诊断、治疗、随访的全流程诊疗。
3.全国首个中医经典医院成立。3月2日,西安国际医学中心医院中医经典医院及中医经典科成立仪式隆重举行。中医经典科负责人鲁维德从事中医工作30年,师承全国知名中医、中国中医科学院博士生导师裴正学教授,他表示,中医经典科将秉承读经典、用经方、回归古中医、回归《伤寒论》的理念,秉持“西医诊断,中医辨证,中药为主,西药为辅”的诊疗思想,致力于切实解决好临床上常见病及部分大病、重病及疑难杂症。
评审动态
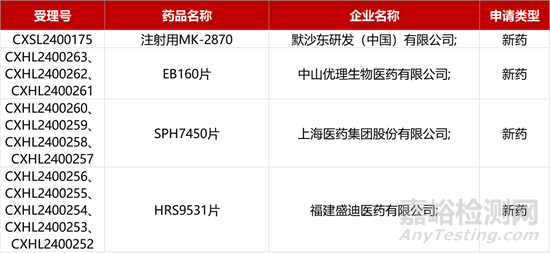
1. CDE新药受理情况(03月10)
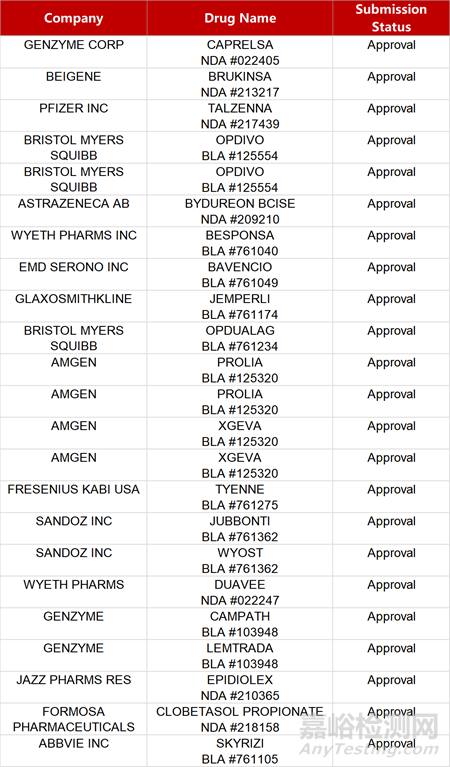
2. FDA新药获批情况(北美03月07日)