当地时间12月14日,欧盟发布MDCG指南文件<MDCG 2023-5 Annex XVI产品认证和分类指南><MDCG 2023-6 Annex产品等同性论证指南>,本次两份指南一方面是针对非医疗用途两份CS:2022/2346和2022/2347的补充,同时从等同性角度,也在MDCG 2020-5指南基础上做了详细的介绍。
MDCG 2023-5非医疗用途产品认证和分类指南
指南导言和范围
无预期医疗用途的产品,如已列入 MDR Annex XVI,并已列入 CS 附件的范围部分,也在 MDR 的覆盖范围内。
无预期医疗用途的产品在分类之前先要进行资格鉴定。只有符合器械资格 并被 CS 和 MDR 涵盖的产品,才应根据 MDR 附件 VIII 和关于重新分类的委员会实施条例 (EU) 2022/2347中规定的规则进行分类。
MDR Annex VIII中所列的分类规则适用于这些产品。欧盟委员会实施条例(EU) 2022/2347也适用于某些无预期医疗目的。MDCG 2021-24<医疗器械分类指南>应与本指导文件一起阅读,但用于医疗目的的器械特定元素除外。
本指南提供了一些有用的要素,可用于将产品认定为MDR Annex XVI所列的无预期医疗用途的产品。它还为某些分类规则在没有预期医疗目的的产品(以下也称为器械)中的应用提供了解释和示例。
资格/Qualification
一般要求
MDR Article (1)仅涵盖医疗器械和医疗器械配件,而MDR Article(2)规定MDR 也适用于Annex XVI中列出的产品。虽然对于“医疗器械”和“医疗器械附件”有定义来确定这两个术语的含义,但对于Annex XVI产品,该规例没有提供任何定义。因此,要确定一个产品是否被MDR 覆盖,必须使用Annex XVI中列出的产品组的描述。不得使用“医疗器械”和“医疗器械附件”的定义。
MDR 适用于从CS申请之日起涵盖一个或一组产品的 AnnexXVI产品。如果一个产品或一组产品没有CS,则MDR 不适用于这些产品。其他欧盟立法也可以适用。有关产品规则实施的有用信息可在the Blue Guide中找到。
产品作为器械的资格认定应依赖于 Annex XVI清单和CS范围部分提供的信息。更确切地说,这些规定中提到的特征,如产品的类型、技术、功能方式、目标身体部位、器官或组织以及产品的预期用途,都应该得到满足。Annex XVI清单和CS范围部分中提供的产品示例应被视为鉴定的额外信息来源,即使它们没有详尽描述。
MDR recital (12)11指出, Annex XVI产品在功能和风险方面应与医疗器械相似。这一指导原则反映在MDR Article 2中,考虑到最新技术水平,特别是基于类似技术的具有医疗目的的类似器械的现有协调标准。因此,与类似医疗器械的相似性也可以被视为产品作为器械资格的指导原则。
附件
MDR Article 2未对Annex XVI产品的附件进行定义。尽管如此,如果Annex XVI 产品的配件符合 MDR Annex XVI 所列的说明,并属于 CS 的适用范围,则属于 MDR 的覆盖范围。
如果该物品只能与Annex XVI 产品结合使用,则可与该产品一起投放市场,并被视为该产品的一部分。
如果该产品可单独使用或与其他Annex XVI 产品结合使用,则可作为Annex XVI 产品单独投放市场,或与其他可兼容的Annex XVI 产品一起投放市场。在后一种情况下,可将其视为这些产品的一部分。
两用设备
如果制造商同时声明医疗和非医疗预期用途,这些器械(称为双重用途器械)必须累计满足适用于具有预期医疗目的的器械和适用于无预期医疗目的的器械的要求。
CS 和 MDR 中的某些要求,如对风险可接受性的要求,可能并不相同。在这种情况下 应适用最严格的要求。
如果一个病人从未同时达到双重目的(例如:(设备可用于医疗目的,也可用于非医疗目的,但绝不能同时用于两者),MDR 和CS要求可参照两种预期目的分别适用。然而,某些要求,如关于 风险控制措施的要求,也应综合考虑,因为为一个预期用途采取的措施可能会对根据另一个预期用途的使用产生影响。与医疗目的风险相关的控制措施可能会产生与非医疗目的相关的新风险,反之亦然。
多种预期用途
MDR Annex XVI 中列出的6类产品中,每一类所描述的产品在预期用途和特性方面有所不同。即使一个产品可以在多个组中描述某些特性,它也不太可能达到多个组的预期目的。因此,原则上,每种产品应只属于MDR Annex XVI中列出的6类之一。然而,如果一种产品达到了两组或两组以上产品的预期目的,并具有这些组中描述的所有特性,则CS中针对这些组所规定的要求应累加应用。
举例:
• 溶脂激光设备:它发射高强度的电磁辐射,去除脂肪组织。如果激光有助于去除脂肪组织,而不提供任何皮肤治疗,产品将只属于第4组。
相反,如果激光有助于去除脂肪组织,并提供皮肤治疗,如皮肤收紧,产品将属于第4和第5组。
• 射频辐射辅助吸脂设备:发射高强度电磁辐射,去除脂肪组织。如果射频辐射有助于去除脂肪组织,而不提供任何皮肤治疗,产品将只属于第4组。相反,如果射频辐射也能起到皮肤治疗作用,比如收紧皮肤,那么该产品就属于第4和第5组。
资格认证的实际问题
MDR Annex XVI所列产品类别的描述,包括规例本身没有定义或详细解释的术语或概念。下表为如何考虑这些术语或概念提供了指导。
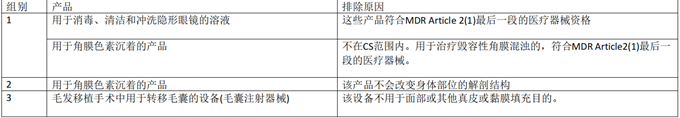
不符合Annex XVI的产品示例
下表提供了一份不应符合 Annex十六产品资格的产品示例的非详尽清单,这些产品不包括在CS中。该清单不包括MDR 和CS直接排除的产品。
分类
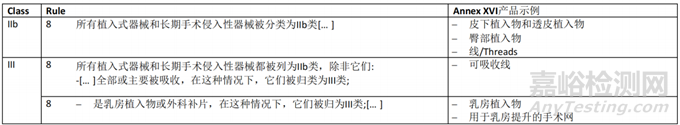
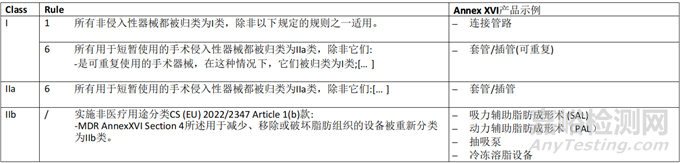
一般原则
MDR 所涵盖的无预期医疗目的的产品分类应按照MDR Annex VIII中规定的规则进行。此外,如果相关,将考虑委员会实施条例(EU) 2022/234718,该条例规定了通过豁免MDR Annex VIII的适用,对某些无预期医疗目的的有源产品进行重新分类的规则。
双用途器械的分类应兼顾医疗和非医疗目的。如果根据器械的预期用途,多个规则或同一规则中的多个子规则适用于同一器械,则应适用最严格规则和导致较高分类的子规则。
关于分类规则的一般考虑,应参考关于分类的 MDCG 2021-24 指南。本指南提供了可能与附件 XVI 产品相关的其他要素和示例本章介绍了CS 所涵盖的MDR Annex XVI 中列出和描述的每组无预期医疗用途的产品应考虑的分类要素。考虑到每组产品的描述都包含可能对其分类有用的产品特性的相关信息(参见第3.1点的评论),从CS中提供产品描述。
GROUP1
CS适用于MDR Annex XVI Section 1中列出的隐形眼镜。CS不适用于含有工具的隐形眼镜,如天线或微芯片,有源器械的隐形眼镜和其他拟引入或进入眼睛的物品。
GROUP2
CS适用于MDR AnnexXVI Section 2中列出的旨在通过手术侵入性手段全部或部分引入人体以改变解剖结构的产品。CS不适用于纹身产品、穿孔产品和旨在通过外科侵入性手段全部或部分进入人体以固定身体部位的产品。CS也不适用于有源植入器械。
GROUP3
CS适用于拟用于皮下、粘膜下或皮内注射或其他引入的面部或其他真皮或粘膜填充的物质、物质组合或物品,不包括纹身,列于MDR AnnexXVI Section 3。CS适用于引入体内的手段,例如注射器和药瓶,其中预先填充MDR Annex XVI Section 3中列出的物质、物质组合或其他物品。CS不适用于有源器械。
GROUP4
CS的光疗产品适用于用于减少、去除或破坏脂肪组织的设备,例如MDR Annex XVI Section 4中列出的吸脂、脂肪溶解或脂肪成形术设备。CS不适用于有源植入器械。
GROUP5
CS适用于用于人体的高强度电磁辐射(例如红外线,可见光和紫外线)发射设备,包括相干和非相干源,单色和广谱,例如激光和强脉冲光设备,用于皮肤换肤,纹身或脱毛或其他皮肤治疗,列于MDR AnnexXVI Section 5。CS也适用于高强度电磁辐射发射设备,用于皮肤年轻化、去除永久性彩妆和非医疗治疗红痣、血管瘤、毛细血管扩张、色素皮肤区域和疤痕,这些设备不属于MDR法规Article第(1)点第二凹痕范围内的伤害。例如,CS适用于治疗痤疮疤痕的产品,但不适用于其他痤疮治疗的器械。CS不适用于使用红外光辐射来加热身体或身体部分的设备,也不适用于日光浴床。
GROUP6
CS适用于用于脑刺激的设备,这些设备施加穿透颅骨的电流或磁场或电磁场来改变大脑中的神经元活动,如MDR法规 Annex XVI Section 6 所列。该设备包括经颅交流刺激、经颅直流刺激、经颅磁刺激和经颅随机噪声刺激的器械。CS不适用于侵入性器械。
MDCG 2023-6非医疗用途产品等同性论证指南
指南导言和范围
MDR法规提供了在符合性评估中器械所需的临床评价中使用与等同器械相关的临床数据的可能性,虽然进行临床调查是为 CE 认证目的生成有关器械安全性和性能的临床数据的最直接方法,但临床数据也可来自可证明与相关器械等效的器械数据。在这种情况下,应根据 MDR 要求证明等同性。
根据欧盟委员会实施条例(EU) 2022/2346制定了医疗器械MDR法规 AnnexXVI中列出的无预期医疗目的产品组的通用规范,以下简称CS,一般而言,在所有可用的临床调查结果仅与医疗器械相关的情况下,不可能证明医疗器械和无预期医疗目的产品之间的等同性。因此,对无预期医疗目的的产品应进行临床研究。
在CS发布之前,2020年4月发布的MDCG 2020-5指南也涵盖了MDR AnnexXVI中列出的无预期医疗目的的产品。目的是突出MDR 与MEDDEV 2.7/1 rev.49之间的差异。
本MDCG指南涵盖了等同性论证,基于与现有器械相关的数据,用于MDR下的CE认证,适用于CS涵盖的MDR Annex XVI中列出的无预期医疗目的的产品。对于双重用途器械,即具有医疗和非医疗预期用途的器械,本指南仅适用于非医疗预期用途。该指南应与MDCG 2020-5关于等同性的指导文件一起使用。
等同证明
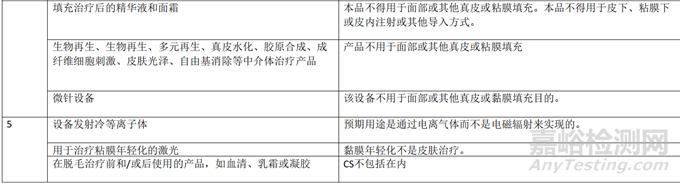
下表提供了一份不应符合 Annex XVI产品资格的产品示例的非详尽清单,这些产品不包括在CS中。该清单不包括MDR 和CS直接排除的产品。
无预期医疗用途的产品vs无预期医疗用途的产品
在参考等同器械的临床数据时,制造商应考虑到,应根据MDR中规定的标准,证明两种无预期医疗用途的器械之间的等同性。
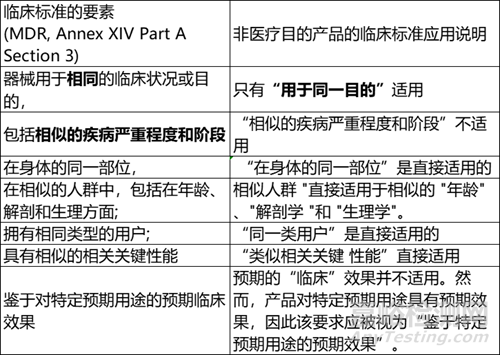
MDR 中列出的技术和生物标准可直接用于比较无预期医疗目的产品的特性。在考虑临床特性标准时,应考虑到其中一些标准是专门针对医疗目的的。下表说明了如何考虑无预期医疗用途产品的特征。
无预期医疗用途的产品vs类似医疗器械
一般来说,医疗器械和无预期医疗用途的产品间不可能进行比较,因为不是所有的临床特征都可以比较。特别是,特征“类似的严重程度和疾病阶段”将被定义并可用于医疗器械,而它将不被定义并可用于没有预期医疗目的的产品。因此,在没有预期医疗目的的器械和具有医疗目的的类似器械之间无法完成和建立等同性证明。
无预期医疗用途的产品vs双重用途器械
没有预期医疗目的的产品与具有医疗和非医疗目的的器械(双重用途器械)之间的等效性可以通过比较两种器械与非医疗目的相关的特性来证明。对于双重用途器械,只应考虑与非医疗用途相关的特性。
如果证明了等效性,则只有与适用于非医疗目的的一般安全和 性能要求相关的双重用途器械的临床数据才能用于无预期医疗目的的产品的临床评价。