近期,美国寺崎生物医学创新研究所的Ali Khademhosseini研究团队在科爱创办的期刊Bioactive Materials上发表文章: 肝素是一种带负电荷的多糖,具有不同的链长和亲水性骨架。肝素因其独特的化学和物理性质、无毒、生物相容性和生物可降解性而被广泛应用于心血管和血液学等医学领域。这篇综述着重介绍了基于肝素的各种生物医学应用材料设计的近期和未来进展。讨论了肝素的物理化学和机械性能、生物相容性、毒性和生物降解性。此外,对肝素类材料在药物/基因传递、组织工程、癌症治疗、生物传感器等生物医学领域的应用进行了综述。最后,总结了肝素材料制备的挑战、机遇和未来的前景。
引言
肝素是由两个重复的二糖组成的糖胺聚糖(GAG);1,4-连接的糖醛酸(D-葡萄糖醛酸(GLCA)或L-艾杜糖酸(IDOA))和D-氨基葡萄糖(GLCN)。肝素是一种线性多糖,由于其结构中含有羧基和磺酸基,因此具有很高的负电荷。体内肝素的生物合成由内质网和结缔组织中肥大细胞的高尔基体,包括肠、肝和肺,通过激活几种酶反应。
肝素的质量和应用主要受肝素相对分子质量的控制。与低分子肝素相比,高分子肝素在水中的溶解和降解速度更慢,因此适合于持续给药或低降解应用。普通肝素(UFH)、低分子肝素(LMWH)和超低分子肝素(ULMWH)是商业上可用的肝素的三个亚类。UFH是纯化后从动物组织中采用的加工最少的肝素形式。LMWH是通过控制UFH的解聚而产生的,ULMWH是一种化学合成的肝素形式,具有与UFH和LWMH相同的五糖序列。
随着最近纳米技术的进步,以及在药物输送和再生医学中使用纳米技术取得的成就,研究人员在研究中越来越多地使用了纳米技术。因此,几种不同尺寸、形态和结构特征的纳米材料已被引入并用于治疗应用。利用这些纳米平台可以通过提高治疗剂在其目标部位的生物利用度并减少其副作用来提高治疗效果。肝素是一种可以融入到纳米材料结构中的激动剂。例如,肝素可以作为纳米载体的包衣剂,并提供一个连接抗炎剂的平台。另一方面,肝素可以与不同类型的细胞因子和趋化因子结合,抑制核转录因子-κB(NF-κB)途径的激活,从而增强细胞因子和趋化因子的抗炎反应。此外,肝素衍生物还可以作为抗癌剂,通过选择性结合促血管生成因子和抑制肝素酶来抑制肿瘤转移和血管生成。
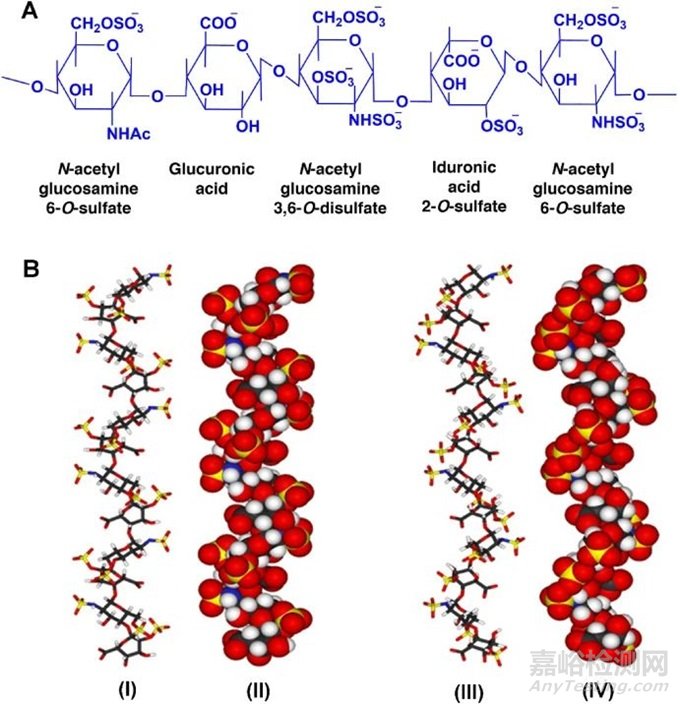
图1 (A)肝素的化学和(B)三维结构。结合核磁共振波谱和分子模拟方法,描述了肝素的三维结构(球棒模型)。在一个模型中,所有的2-O-磺酸-α-L-艾杜糖醛酸都是2S0构象(I和II),而在另一个模型中(III和IV),它们都是1C4构象。
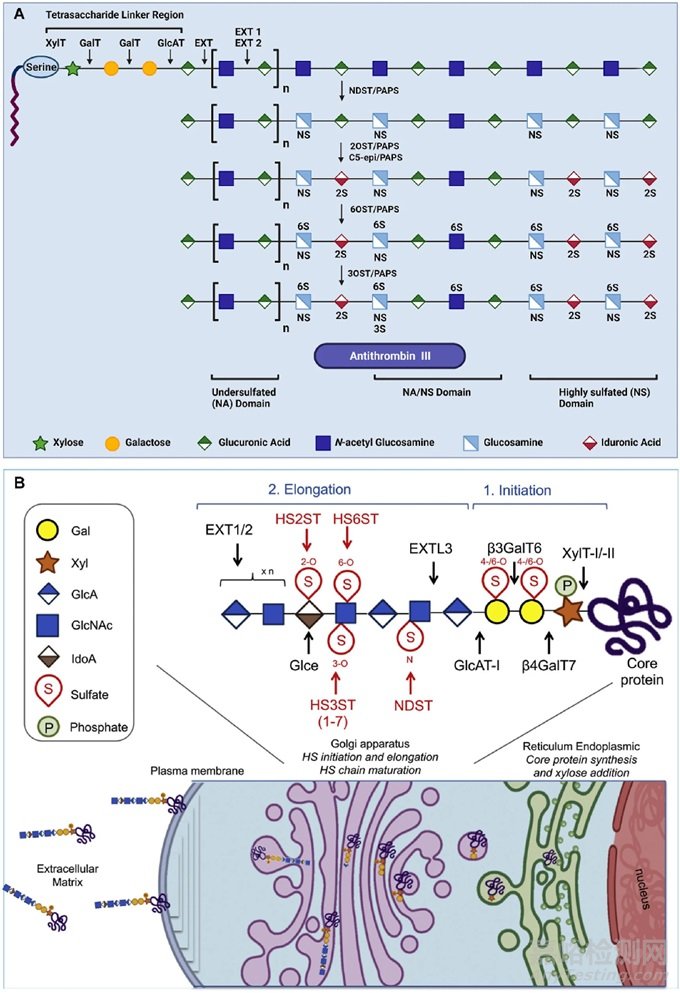
图2 细胞内肝素和硫酸肝素的生物合成以及高尔基体和内质网通过几种酶反应的成熟。(A)核心蛋白首先在内质网中产生。然后一步一步地将四糖连接物连接到蛋白质的丝氨酸残基上,然后聚合多糖链。木糖,半乳糖,丝氨酸,NA:亚硫化结构域,NS:高硫化结构域。Ext:Exostosin;Exostosin-1和Exostosin-2分别是人类EXT1和Ext2基因所表达的蛋白质。抗凝血酶III是一种小的糖蛋白抗凝剂,可使凝血系统的几种酶失活。(B)硫酸乙酰肝素蛋白多糖在细胞外基质中转移或附着在质膜上以发挥其生物学功能。
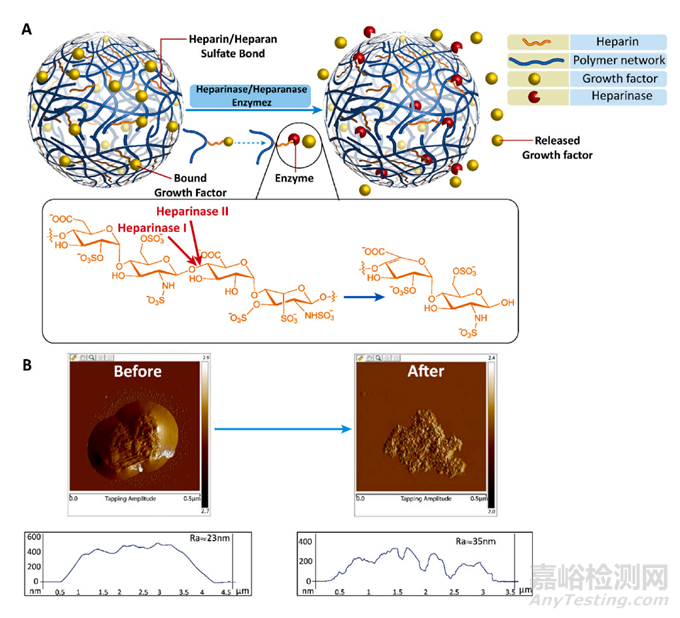
图3 合成肝素/硫酸肝素键的示意图,以及肝素酶如何用于释放生长激素。(A)活跃的生长因子释放机制是由于在肝素酶/肝素酶存在的情况下肝素/肝素硫酸酯键被破坏而发生的。(B)乙酰肝素酶作用前后含有纳米胶囊的肝素的原子力显微镜图像。
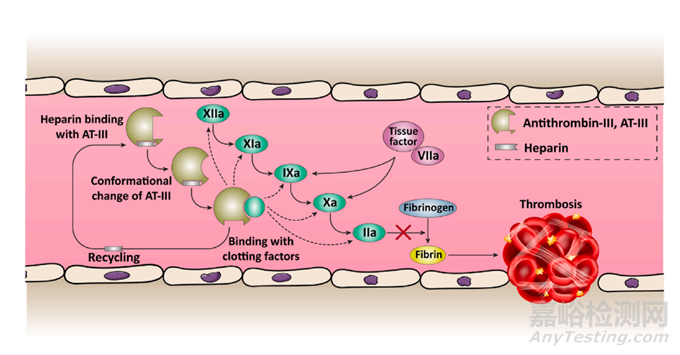
图4 肝素抗凝活性示意图。肝素和抗凝血酶 (AT)-III 之间的相互作用导致 AT-III 结构发生构象变化,使其适合附着于凝血因子并抑制凝血途径。
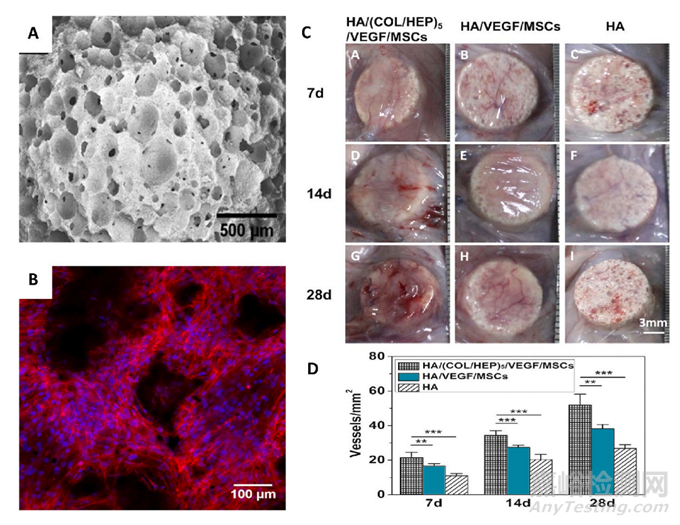
图5 在支架结构中使用肝素以提高血管化率。(A) 多孔 HA/(COL/HEP)5 支架的 SEM 图像。(B) 支架内间充质干细胞分布的共焦显微图像。(C) 植入物周围血管形成率的差异取决于肝素的存在和不存在。(D) 暴露不同成分的组织切片 7、14 和 28 天后形成的新血管数量。
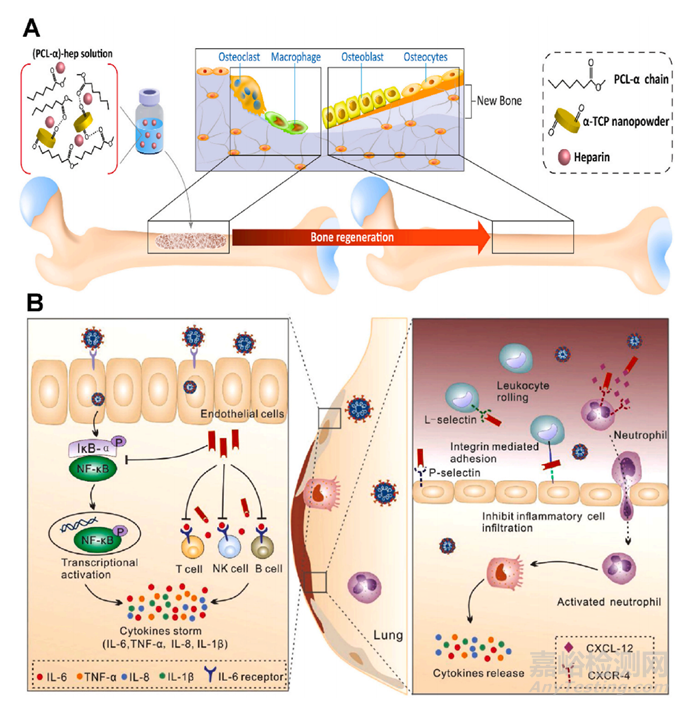
图6 肝素负载PCL-α纤维膜的合成及其抗凝和血液相容性研究。(A) 用于骨缺损的负载肝素的 PCL-α-TCP 纤维膜的示意图。(B) 肝素对抗肺部 COVID-19 炎症的抗炎机制。肝素可以通过阻止 IL-6 功能并抑制炎症细胞浸润,作为抗击 COVID-19 的抗炎剂。
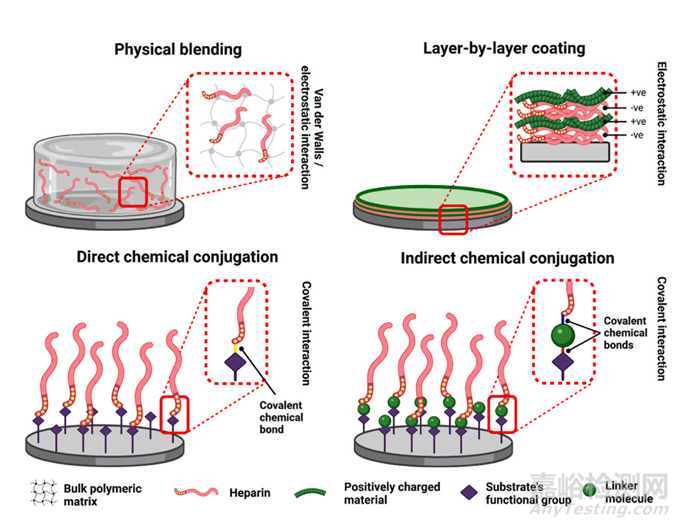
图7 不同的肝素化策略——物理混合、逐层包衣、直接/间接化学结合。在物理混合中,肝素被混合到本体基质中并通过范德华力或静电相互作用(左上)相互作用。逐层涂层主要涉及静电相互作用,与其他带正电的材料形成聚电解质复合物(右上)。在化学缀合策略中,肝素直接(左下)或通过连接分子(右下)共价连接到本体基质。
图8 用于心脏组织再生的醛修饰HA、乙二醇壳聚糖和PEDOT复合导电水凝胶的合成。(A) 导电复合材料 HA-ALD/GC/PEDOT 的制备。(B) 使用电路描绘的水凝胶的自愈特性。(C) 导电水凝胶的粘合性能。(i) 水凝胶与鸡心有效粘附。即使在(ii)用水冲洗或(iii)浸入水中后,水凝胶仍保持粘附。(D) 在水凝胶中培养 7 天后 C2C12 细胞活/死染色后的代表性图像(比例:200 μm)。(E) 用肌钙蛋白 T 免疫染色的 C2C12 细胞的代表性图像(绿色),表明诱导肌生成(比例:100 μm)。细胞核用 DAPI 染色。
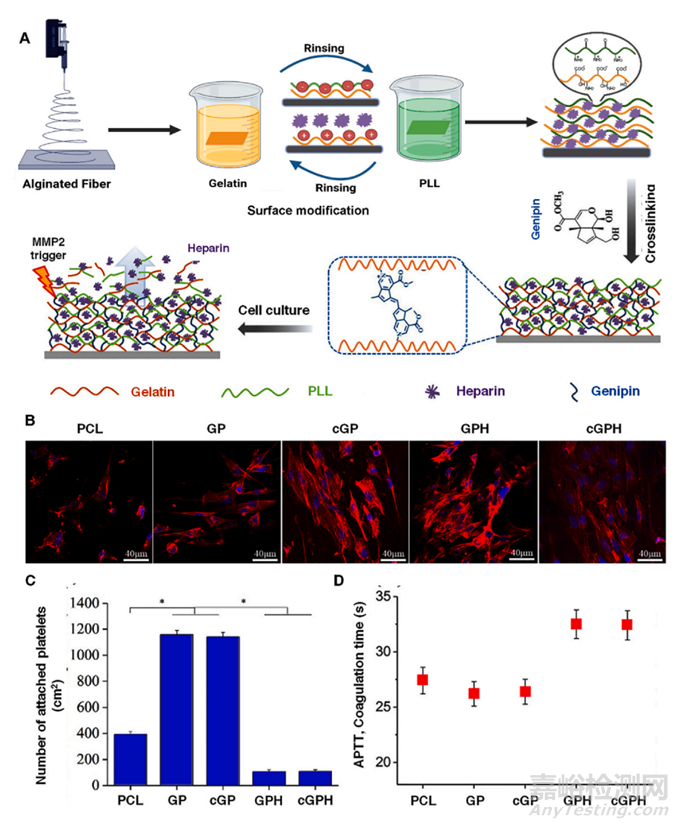
图9 涂有明胶、PLL 和肝素的氨解聚-ε-己内酯电纺支架,用于血管组织工程。(A) 用明胶、PLL 和肝素逐层涂覆电纺 PCL 支架以形成纳米涂层的制备示意图。然后支架与 Genepin 交联,并进一步用于细胞培养应用,其中肝素以 MMP2 依赖性方式释放。(B) 第 5 天时 HUVEC 的代表性荧光显微照片(比例:40 μm)。肌动蛋白细胞骨架用荧光红鬼笔环肽染色,而细胞核用 DAPI 染色。(C) 不同支架上血小板粘附的定量。(D) 不同支架的贫血小板血浆的 APTT 凝固时间。
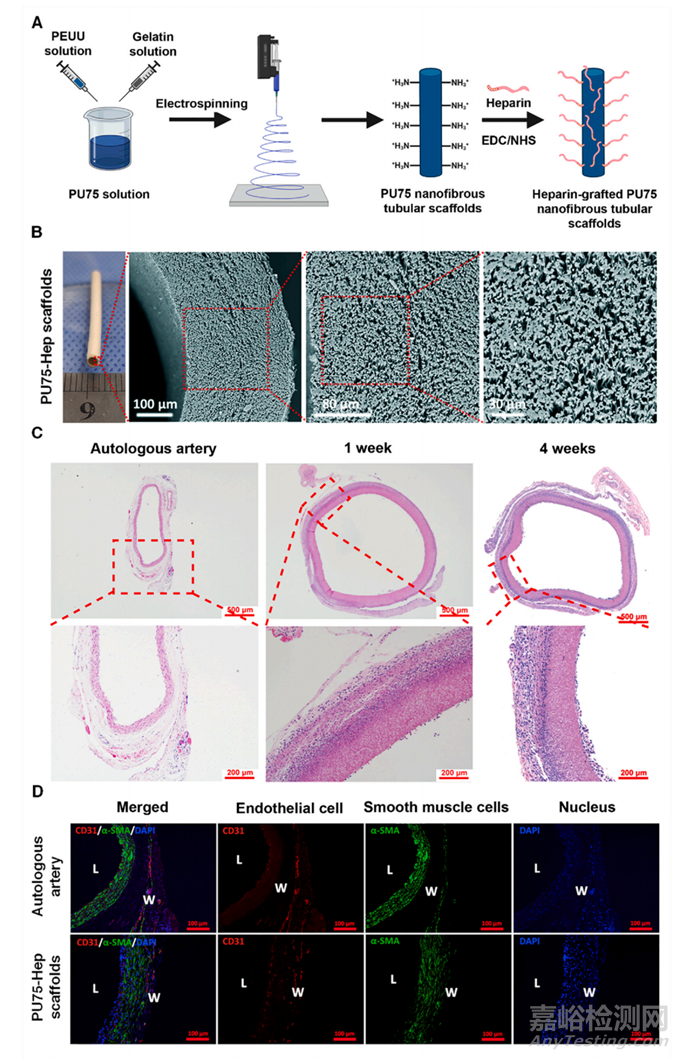
图10 用于血管组织工程的肝素接枝聚(酯-氨基甲酸酯)脲/明胶电纺管状支架的合成。(A) PU75-Hep 纳米纤维管状支架的制作示意图。(B) PU75-Hep 支架的数字图像和扫描电子显微照片。(C) H&E 染色的自体动脉和 PU75-Hep 支架的代表性显微照片(植入后 1 周和 4 周)(比例尺:500 μm;缩放图像:200 μm)。(D) 自体动脉和 PU75-Hep 支架(植入后 4 周)的代表性图像,用 CD31(内皮细胞)和 α-SMA(平滑肌细胞)进行免疫染色(比例尺:100 μm)。
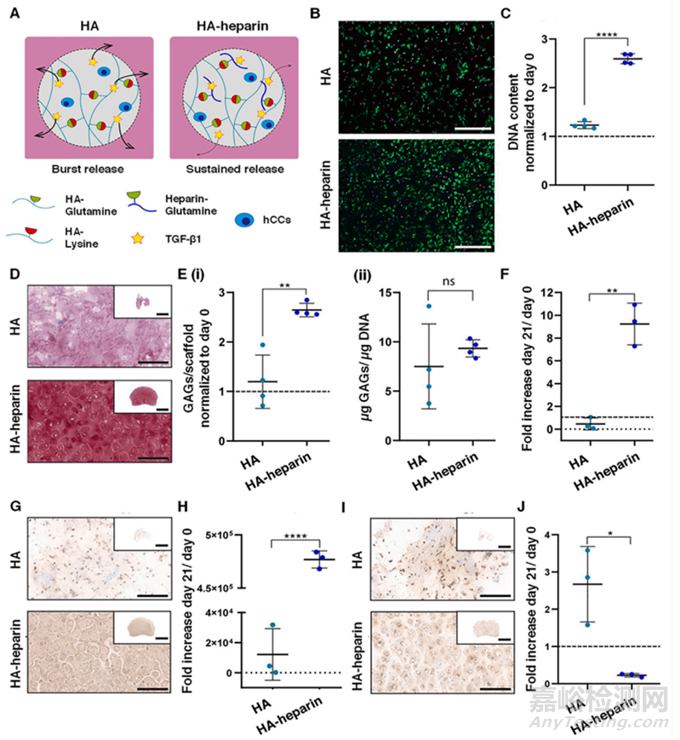
图11 (A) 负载 TGF-β1 的 HA 和 HA-肝素水凝胶与转谷氨酰胺酶因子 XIII 进行酶交联的图示。含肝素的水凝胶表现出 TGF-β1 持续释放曲线。(B) 活/死染色后水凝胶中 hCC 的代表性图像(比例尺:200 μm)。(C) 水凝胶中细胞增殖的定量。(D) 番红 O 染色水凝胶的代表性图像(比例:200 μm)。(E) 沉积的 GAG 定量,标准化为 (i) 第 0 天或 (ii) DNA 含量。(F) 两种水凝胶中第 0 天的第 21 天聚集蛋白聚糖基因表达的定量。针对 (G) II 型胶原和 (I) I 型胶原的免疫染色水凝胶切片的代表性图像(比例:200 μm)。两种水凝胶中第 0 天的 (H) II 型胶原蛋白和 (J) I 型胶原蛋白在第 21 天的基因表达定量。插图代表整个水凝胶部分的显微照片(比例:2 毫米)。
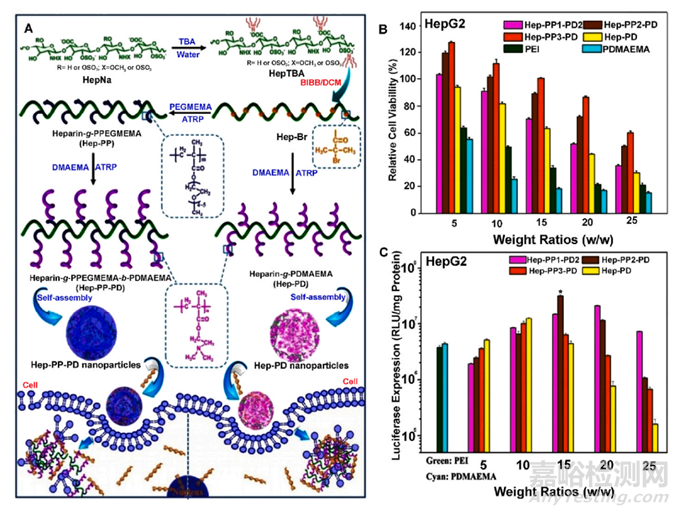
图12 (A) 通过原子转移自由基聚合 (ATRP) 对肝素进行接枝修饰,以及由此产生的基于肝素的纳米颗粒的基因传递过程。(B) 在不同重量比的 HepG2 细胞系中,PPEGMEMA-bPDMAEMA(Hep-PP-PD)、肝素-gPDMAEMA(HepPD)、聚乙烯亚胺 (PEI) 和聚(二甲氨基乙基甲基丙烯酸酯) (PDMAEMA) 的 MTT 测定(平均± SD, n = 6)。(C) 与对照 PEI(最佳 N/P 比)相比,不同重量比的 Hep-PP-PD 和 Hep-PD 介导的 HepG2 细胞系的体外基因转染效率10) 和 PDMAEMA(最佳 N/P 比为 15)。
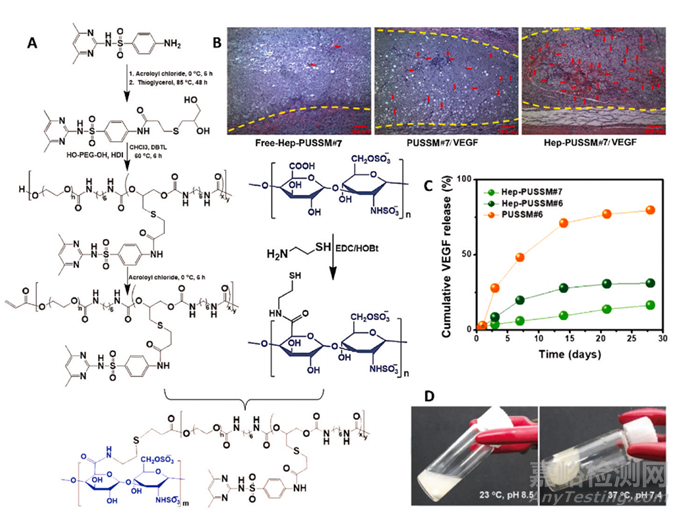
图13 pH 和温度敏感肝素水凝胶的示意图。(A) 含有 pH 和温度敏感肝素的水凝胶的合成。(B) 在含有 VEGF 的水凝胶存在下血管形成的 H & E 染色图像(比例尺 = 100 μm)。(C) 在存在和不存在肝素的情况下,VEGF 从水凝胶中的体外释放模式。(D) 体外 pH 响应凝胶形成。
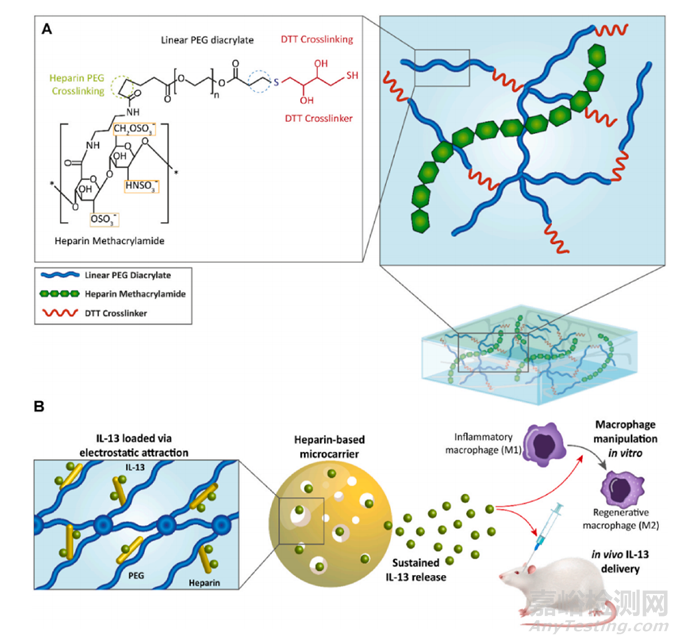
图14 基于肝素的水凝胶(肝素/PEG-二丙烯酸酯),用于持续释放结晶紫作为抗炎药物。(A) 使用肝素甲基丙烯酰胺、线性 PEG-二丙烯酸酯和 DTT 交联剂制造水凝胶。(B) 基于肝素的微载体用于在体外修饰巨噬细胞的表型,并在动物大脑中的巨噬细胞/小胶质细胞中创建促再生表型。
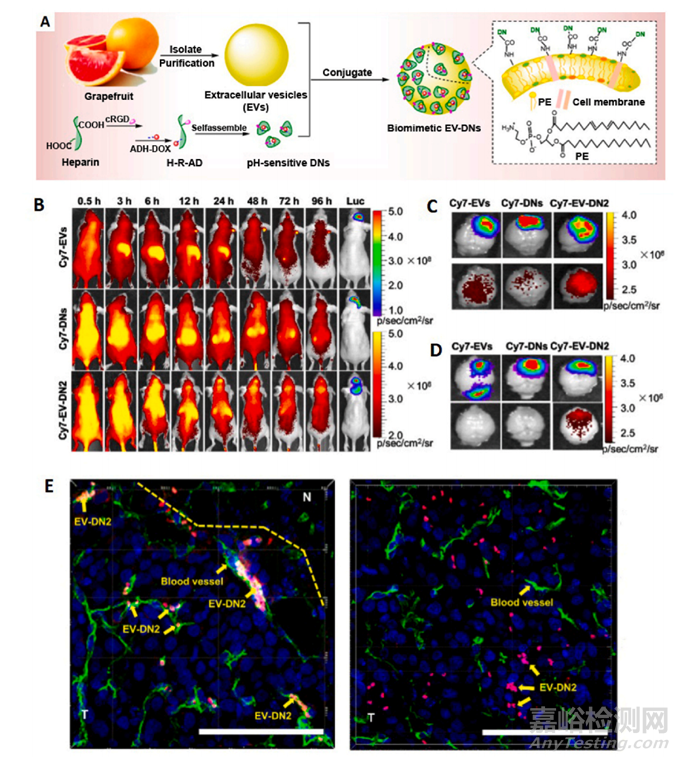
图15 在天然葡萄柚细胞外囊泡的表面上制备基于阿霉素/肝素的纳米颗粒。(A) 仿生 EV-DNPs 递送系统的制备。(B) 施用 Cy7-EV、Cy7-DNP 和 Cy7-EV-DN2 后不同时间点的颅内 LN229-luc 神经胶质瘤小鼠的体内荧光图像。注射 Cy7-EV、Cy7-DNP 和 Cy7-EVDN2 后 96 小时,检查从 LN229-luc 神经胶质瘤小鼠中切除肿瘤的大脑的离体 Cy7 和 Luc 信号。(C) 无灌注和 (D) 有灌注。(E) EV-DN2 静脉注射诱导的胶质瘤脑组织 3D 共聚焦图像(左图,胶质瘤边缘;右图,胶质瘤核心)。内皮细胞从肿瘤动脉(绿色)中渗出,细胞核用 Hoechst 33342 和 EV-DN2(红色)染色,并在肿瘤组织内积累。(比例尺:100 m;T = 肿瘤组织;N = 正常组织。)细胞外囊泡,或EV。
图16 用盐水、LMWH、游离 ICG、LMWH-ICG-Lip、游离 ICG/激光和 LMWH-ICG-Lip/激光治疗的小鼠的体内治疗效果(808 nm,1.5 W/cm2,5 分钟) , n=6。(A) 治疗时间线示意图;(B) 肿瘤体积;(C)第21天所有组的肿瘤;(D) 第 21 天接受各种治疗的 4T1 荷瘤小鼠。(E) 肿瘤组织的苏木精-伊红 (HE) 组织病理学图像(比例尺,400 μm)。(F) 肿瘤重量;(七)体重变化。(H) 肺组织上的结节总数;(I)用各种制剂处理的小鼠肺中的转移性肿瘤位置和HE染色的肺组织切片以圆圈显示(比例尺,400μm)。缩写;NF=未发现肿瘤。NS = 无显着差异。*p < 0.05,**p < 0.01。
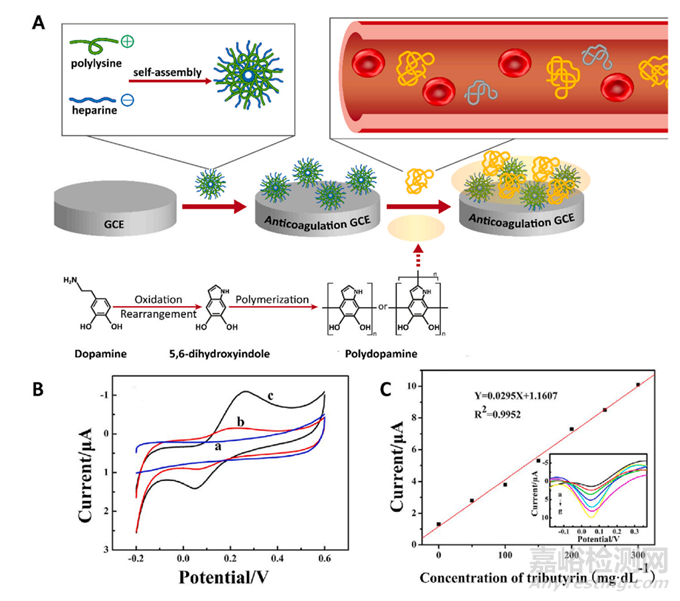
图17 用于电催化活性的脂肪酶-(ε-聚赖氨酸-肝素)-玻碳电极的制备。(A) 脂肪酶-(ε-聚赖氨酸肝素)-GCE 生物传感器的制作示意图。(B) a) (ε-PL-Hep)-GCE、b) 脂肪酶-HepGCE 和 c) 脂肪酶-(ε-PL-Hep)-GCE 在 PBS 中的循环伏安图。(C) 校准曲线和插图:在脂肪酶-(ε-聚赖氨酸肝素)-GCE 生物传感器存在下,三丁酸甘油酯的微分脉冲伏安法 (DPV)。GSE:玻碳电极。
结论与展望
本文对肝素及其衍生物作为FDA批准的抗凝成分之一的优异特性和应用进行了详细研究,由于肝素及其衍生物具有抗凝活性高、生物相容性好、可生物降解等独特特性,衍生物,无论是合成的还是天然的,已被用于多个生物医学领域。这些领域包括但不限于癌症治疗、组织再生、伤口愈合和生物传感器。已经证明,肝素的某些特定特征仅在特定类型的肝素中出现,这使得它们适合特定的应用;例如,LMWH 的抗转移、抗增殖、抗血管生成和肝脏首过逃逸能力使其在递送应用中具有索引作用。此外,该GAG组分结构中存在不同的官能团,使其适合于具有各种特征的其他物理和化学相互作用,从而诱导肝素的新特性,从而扩展其当前的应用。
采用了基于透明质酸和明胶衍生物等不同天然材料的药物输送装置,例如微针。鉴于此,基于肝素的微针贴片的制备也可能是未来的研究兴趣之一。尽管对基于肝素的可注射水凝胶平台进行了广泛的研究,但基于肝素的平台的实际应用可能是前瞻性的指导之一。基于肝素的平台的工业和临床应用研究还不够。未来可以解决的另一个主题是合成基于肝素的共聚物或与固有导电聚合物的共混物,例如聚苯胺及其衍生物、聚吡咯和聚噻吩,用于制备导电水凝胶,用于通过光热治疗和愈合伤口及其在神经再生中的应用。另一方面,关于基于肝素的纳米平台在生物成像和抗菌活性中的应用的研究很少,因此它们是未来进一步研究有益生产和商业材料的有用领域。
原文信息
Ehsan Nazarzadeh Zare, Danial Khorsandi, Atefeh Zarepour, Hulya Yilmaz, Tarun Agarwal, Sara Hooshmand, Reza Mohammadinejad, Fatma Ozdemir, Onur Sahin, Sevin Adiguzel, Haroon Khan, Ali Zarrabi, Esmaeel Sharifi, Arun Kumar, Ebrahim Mostafavi, Negar Hosseinzadeh Kouchehbaghi, Virgilio Mattoli, Feng Zhang, Vadim Jucaud, Alireza Hassani Najafabadi, Ali Khademhosseini.
Biomedical applications of engineered heparin-based materials.
https://10.1016/j.bioactmat.2023.08.002