今日头条
南京清普长效镇痛新药国内报产。清普生物自研非阿片类镇痛新药QP001注射液上市申请获CDE受理。QP001是清普生物专有难溶药物增溶技术平台(SimSol)开发的首款产品,可用于治疗各类急性疼痛,尤其适用于围术期镇痛,在镇痛强度、安全性和镇痛维持时间上均有一定优势。今年7月,FDA已受理该新药的新药上市申请(NDA),PDUFA日期为明年2月26日。
国内药讯
1.K药中国获批治疗MSI-H/dMMR型晚期实体瘤。默沙东PD-1抑制剂帕博利珠单抗(商品名:可瑞达®)获国家药监局批准用于不可切除或转移性微卫星高度不稳定型(MSI-H)或错配修复基因缺陷型(dMMR)晚期实体瘤经治患者。在II期临床KEYNOTE-158中,不同类型的经治转移性实体瘤患者接受Keytruda单药治疗,TMB-H患者的总缓解率(ORR)达到30.3%;而非TMB-H患者中ORR为6.7%。2021年,该新药已被NMPA批准用于MSI-H/dMMR型结直肠癌一线治疗。
2.度伐利尤单抗新适应症中国报产。阿斯利康PD-L1抑制剂度伐利尤单抗(Imfinzi)的第4项适应症上市申请获CDE受理。度伐利尤单抗通过阻断PD-L1与PD-1和CD80的结合,从而阻断肿瘤免疫逃逸并解除对免疫反应的抑制。此前,NMPA已批准度伐利尤单抗用于治疗非小细胞肺癌和小细胞肺癌的两项适应症;度伐利尤单抗联合化疗一线治疗局部晚期或转移性胆道癌的上市申请也已获CDE受理。
3.曙方引进DMD新药拟纳入突破性品种。曙方医药与Santhera公司联合开发的1类化药vamorolone口服混悬液获CDE拟纳入突破性治疗品种,用于治疗杜氏肌营养不良(DMD)患者。Vamorolone是一种创新类固醇药物,能够选择性地激活类固醇的某些信号通路,引发抗炎症疗效,并避免传统类固醇所带来的安全性顾虑与副作用。目前,该新药的上市申请正接受FDA的监管审查,PDUFA日期为10月26日。
4.维亚臻siRNA新药拟纳入突破性品种。维亚臻生物小干扰RNA(siRNA)药物VSA001注射液获CDE拟纳入突破性治疗品种,用于降低家族性乳糜微粒血症综合征(FCS)成人患者的甘油三酯水平。VSA001可通过有效且持久地沉默载脂蛋白C3的信使RNA(APOC3 mRNA)来降低APOC3蛋白水平表达。目前,该新药正在中国Ⅲ期临床中评估用于FCS成人患者的有效性与安全性。
5.康方PD-1/CD73双抗获批实体瘤临床。康方生物1类生物药AK131注射液获国家药监局临床许可,拟开发用于非小细胞肺癌、食管癌、胰腺导管腺癌、肝细胞癌等晚期实体瘤的治疗。AK131是一款靶向PD-1和CD73的双抗药物,可有效阻碍PD-1/PD-L1的相互作用,还可以有效的抑制CD73的活性并促进细胞对CD73的内吞。在临床前小鼠模型中,AK131已显示积极的体内抗肿瘤活性,可100%抑制肿瘤生长。
国际药讯
1.创新CXCR4拮抗剂在美国报NDA。X4 Pharmaceuticals公司向FDA提交CXCR4拮抗剂mavorixafor的新药申请,用于治疗≥12岁、WHIM(疣、低丙种球蛋白血症、感染和骨髓炎)综合征患者。这是一种罕见的原发性免疫缺陷病。在Ⅲ期临床4WHIM中,与安慰剂相比,mavorixafor显著改善患者TATANC值(24小时内维持中性粒细胞数大于500个细胞/微升的时间),两组平均TATANC分别为15.04小时与2.75小时(P<0.0001)。和誉医药拥有mavorixafor的大中华区权益。
2.PPARδ激动剂肝病Ⅲ期临床成功。CymaBay 公司潜在“first-in-class”的过氧化物酶体增殖物活化受体(PPARδ)激动剂seladelpar治疗原发性胆汁性胆管炎的Ⅲ期试验RESPONSE达到主要和所有关键次要终点。与安慰剂相比,seladelpar(10 mg)治疗12个月时达到血清碱性磷酸酶和胆红素相关的主要复合终点的患者比例更高(61.7%vs20.0%,p<0.0001);达到碱性磷酸酶正常化的患者比例为25.0%(vs0%,p<0.0001)。seladelpar的安全性与既往研究一致。
3.罗氏引进高血压RNAi疗法II期研究成功。罗氏与Alnylam开发的靶向血管紧张素原(AGT)的RNAi疗法zilebesiran治疗轻中度高血压的II期KARDIA-1研究达到主要终点和关键的次要终点。Zilebesiran(300mg和600mg)治疗3个月后,患者24小时平均收缩压降幅均超过15mmHg(p<0.0001);且疗效持续长达6个月,支持每季度或每半年给药一次。此外,药物的安全性和耐受性良好。
4.创新DNA疫苗获FDA突破性疗法认定。INOVIO公司潜在“first-in-class”DNA疫苗INO-3107获FDA授予突破性疗法认定,用于治疗复发性呼吸道乳头状瘤病(RRP)。INO-3107利用DNA质粒表达与HPV-6和HPV-11相关的抗原,旨在激发T细胞的靶向应答,以达到杀死已被感染的细胞,阻止或延缓新乳头状瘤的生长。此前,该新药已获得欧盟委员会和FDA授予的孤儿药资格。
5.第一三共MUC1靶向ADC上Ⅰ/Ⅱ期临床。第一三共靶向TA-MUC1 的ADC药物DS3939在治疗晚期实体瘤的Ⅰ/Ⅱ期临床完成首例患者给药。这是第一三共与Glycotope公司合作开发的一款DAR值为8的ADC药物,采用Glycotope的抗TA-MUC1抗体。该产品也是第一三共DXd-ADC技术平台第6款进入临床阶段的ADC新药,前5款分别是HER2 ADC、Trop2 ADC、HER3 ADC、B7-H3 ADC、Claudin6 ADC。
6.AZ布局神经退行性疾病靶向疗法。阿斯利康与维智基因(Verge Genomics)将利用后者专有ConVERGE平台,合作开发创新靶向药物,用于治疗罕见神经退行性和神经肌肉疾病。ConVERGE平台将人体组织的基因组数据集与机器学习相结合,能够识别并发现潜在的新兴靶点。根据协议,维智基因将获得高达4200万美元的预付款和研究资金,和最高达8.4亿美元的里程碑后期款项。
医药热点
1.湖北三院神经内科记忆门诊开诊。近日,湖北省第三人民医院(省中山医院)开设了“记忆门诊”。神经内科记忆门诊为湖北省第三人民医院神经内科高级认知障碍中心附设的专病门诊,是专门针对记忆力减退、痴呆、性格行为改变等症状和疾病的门诊窗口。记忆门诊除了治疗痴呆的患者,另外一项重要的任务就是早期筛查发现早期的痴呆患者,实现并推广国际化的标准治疗,延缓疾病的进一步发展。
2. 北京上线医保移动支付功能。为解决北京参保人员就医时缴费排队等待等问题,北京市26家医院9月3日起上线了医保移动支付功能。该市参保患者通过支付宝、微信中的“京通”小程序,激活本人医保电子凭证,可实现医事服务费和门诊诊疗费用的个人支付部分线上支付,医保报销费用在线分解扣除,无需再到人工窗口、自助机排队缴费,患者仅需通过一部手机,即可完成从预约挂号、医保报销的全流程掌上办理业务。
3.江西人工耳蜗纳入医保。近日,江西省医保局发布《江西省医保医用耗材支付管理目录(2023年)》,并将于9月30日起执行。其中,备受关注的人工耳蜗成为新增条目,纳入医保乙类支付,支付标准为155395元,在155395元支付标准以内部分可由参保人和医保基金按比例分担,超出支付标准的部分则由参保人自付。目前,辽宁、吉林、河南等省份也已将人工耳蜗列入医保报销范围,安徽新农合和山东职工医保也已经纳入人工耳蜗。
评审动态
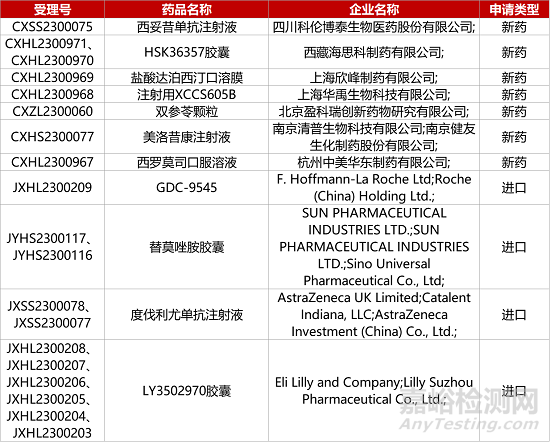
1. CDE新药受理情况(09月09日)
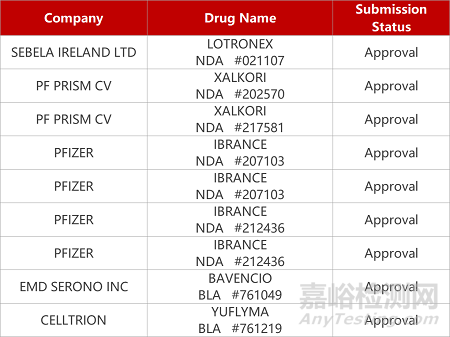
2. FDA新药获批情况(北美09月08日)