稳定性研究是药物研发中的重要环节,贯穿研发初始至生产的全过程。稳定性研究是在基于对原料药或制剂及其工艺的深刻理解的基础上,通过合理的设计来研究原料药或制剂在各种环境因素影响下其关键质量属性随时间的变化规律,不仅为包装材料、贮藏条件、复验期(货架期)的选择与制定提供数据支持,也是质量标准限度制定的重要依据,同时也能为制剂工艺和处方设计合理性的提供补充支撑。
稳定性研究的对象分为原料药和制剂,研究内容包括影响因素试验、加速试验、长期试验。对于制剂样品除进行以上的稳定性研究外,还应根据需要进行使用中稳定性。此外,所有制剂均应充分考虑运输、包装、储存及温度监控等对产品质量的影响。
本文结合工作经验探讨稳定性研究的试验设计及稳定性研究数据评价。
1、 原料药
1.1稳定性试验设计
1.1.1影响因素试验
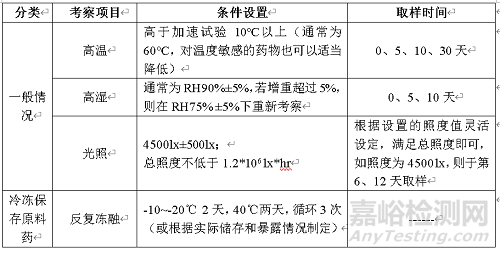
原料药影响因素试验体现药物固有稳定性,通过影响因素试验可以了解影响稳定性的因素和可能的降解途径及产物,可为制剂工艺设计、包装、贮存条件选择及分离方法建立提供依据。影响因素试验采用1批样品,试验设计见下表。
表1 原料药影响因素试验设计表
影响因素注意事项:
1) 样品放置
A:所有样品均应均匀分散在适当的敞口容器内,推荐使用玻璃器皿,厚度不超过3 mm。
B:在进行任意一项考察时尽量使药物受被考察因素之外的因素的影响最小化,如进行高湿试验时尽量选择棕色干燥器,避免因光照的影响导致错误的结论。
C:要充分考虑药物的物理性质,例如对于易升华样品,在光照试验时可选择冷藏条件或者密闭容器,以确保药物物理状态变化的影响最小。
2) 样品分析
取样后,应立即检查外观的变化(必要时拍照留存),并采用经验证的方法进行含量、有关物质等反应产品质量项目的检测。对于固体样品,要注意取样的代表性,尤其是光照条件。
3)结果判断
影响因素试验结束后,要评价高温、高湿、光照所引起的变化是否可接受,并确认后续制剂生产和处方设计中的必要预防措施,同时对包装材料的选择做出初步推荐,例如对光和湿度敏感的药物,在制剂工艺中应避光操作,同时避免湿法制粒等制剂工艺,包装也应选择铝箔等避光材料。
1.1.2加速试验
加速试验的目的是通过加速药物的理化变化来考察药物稳定性,为制剂设计、包装、贮存和运输条件选择提供依据,加速试验设计见下表。
表2 加速试验设计表
加速试验注意事项:
1)加速试验采用三批样品进行。
2)原料药加速试验包装可采用模拟小桶但封装条件及所用材料应与大桶一致。
3)在一般情况下,如果在加速6个月内任意时间点发生显著变化,应增加中间条件,并根据中间条件的考察结果来确定复验期。
4)对于需冷藏保存的原料药,如果在加速试验下3~6个月期间发生显著变化,应根据长期试验的实际数据确定建议的复验期,不能采用外推法;如果在前3个月内即发生显著变化,应考察短期偏离贮存条件对药物的影响,必要时,可选择一批原料药进行3个月内取样更频繁的稳定性考察。
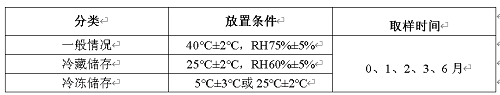
1.1.3长期试验(含中间条件)
表3 长期试验设计表
注1:此条件也是中间条件
长期试验注意事项:
1)长期试验采用三批样品进行。
2)原料药长期试验包装可采用模拟小桶但封装条件及所用材料应与大桶一致。
3)长期试验的条件有两个,分别为25℃±2℃,RH60%±5%和30℃±2℃,RH65%±5%,选择哪个都可以,如果选择30℃±2℃,RH65%±5%的条件作为长期试验条件则无需再进行中间试验;如果选择25℃±2℃,RH60%±5%的条件作为长期条件,且在加速试验过程中发生了“显著变化”,则应增加中间放置条件。
1.2稳定性承诺
创新药申报时通常长期稳定性数据还无法涵盖建议的复验期,因此需承诺批准后对已开展稳定性研究的样品继续进行稳定性研究,直至建议的复验期;如果申报时进行稳定性研究的样品不包括生产批次,还需承诺对生产规模生产的前三批样品进行长期稳定性研究,直至建议的复验期。
1.3稳定性数据评价
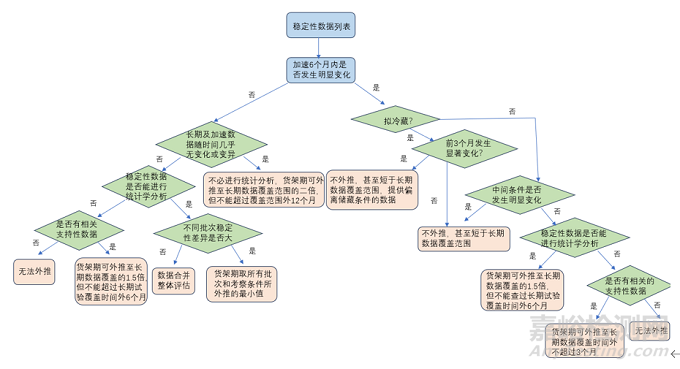
稳定性研究最重要的目的是建立所有在相似条件下产出来的原料药的复验期。稳定性数据评价决策树如下图:
依据决策树,对于不可外推及数值不随时间变化且变异较小的样品,复验期确认较为简单,对于那些随时间变化的定量参数,复验期的计算需要通过统计分析得出,复验期计算流程如下:
1)指标选择
通常情况下,选择可以定量的,与安全性、有效性相关的指标,例如有关物质(包括:特定杂质、单一最大杂质、总杂质)、异构体、含量等。
2)数据变异性评估
将各批样品稳定性数据以时间为横坐标,以定量参数的测定值为纵坐标做回归分析并对每批样品的回归曲线斜率和截距进行协方差检验,以显著性水平0.25判断是否具有显著差异,能否将数据合批。如不能合批,分批计算的复验期中取最短者。
3)拟合度评价
降解程度与时间的关系可通过拟合函数表示,一次、二次或三次函数都有可能,做拟合时尽量选择拟合度高的函数,也就是相关系数接近1的函数,拟合度越高结果越准确。
4) 复验期计算
对于数值随时间推移降低的参数,将回归曲线95%置信下限与标准的相交点所对应的时间作为复验期;对于数值随时间推移增长的参数,将回归曲线95%置信上限与标准的相交点所对应的时间作为复验期。需要从所有影响产品质量的关键指标所计算的复验期中取最短者。
5)计算方法
对于复验期计算可以采用EXCEL 6SQ加载项,得到95%置信限的回归方程,将指标的限度带入方程得到的X值即为复验期;也可以采用Minitab软件,将稳定性数据和限度值输入并选择模型后可直接得到95%置信区间的回归方程并自动计算出复验期。
2、制剂
制剂正式稳定性研究是在对热、湿度、光照对原料药影响的理解基础上,在处方筛选和工艺设计过程中充分了解API与辅料性质后设计的影响因素、加速和长期稳定性试验,同时为考察产品使用过程中对产品质量的影响还应进行产品使用中稳定性考察。
2.1稳定性试验设计
2.1.1影响因素试验
制剂影响因素试验目的是考察制剂处方及生产工艺的合理性并为包材选择提供依据,采用1批样品进行影响因素试验,一般情况下,影响因素设计见下表。
表4 制剂影响因素试验设计表
注2:对于液体制剂可不考察高湿
上表是一般制剂的影响因素考察条件设计,为考察一些特殊药品(如易发生相分离、沉淀、聚集或粘度减小的药品)在运输中或使用中因温度变化而可能造成的不利影响,还应进行低温循环或冷冻循环试验。下表是化学药物(原料药和制剂)稳定性研究技术指导原则中低温循环及冷冻循环试验方法的描述,在实际的稳定性设计中,也可参照样品实际可能接触的温度偏离来设计,只要能涵盖注实际温度变化范围和可能的接触时间即可。
表5 特殊制剂低温或冷冻循环稳定性设计表
|
低温循环
|
2~8℃两天,40℃两天,循环三次
|
|
冷冻循环
|
-20~-10℃两天,40℃两天,循环三次
|
影响因素注意事项:
1) 样品放置
A:分别取市售包装、除去外包装和除去内包装样品,置于适当的开口容器内并且确保样品最大面积的接触环境。
B:在进行任意一项考察时尽量使药物受被考察因素之外的因素的影响最小化,如进行高湿试验时尽量选则棕色干燥器,避免因光照的影响导致错误的结论。
C:要充分考虑药物的物理性质,例如对于易升华样品,在光照试验时可选择冷藏条件或者密闭容器,以确保药物物理状态变化的影响最小。
2) 样品分析
取样后,应立即检查外观的变化(必要时拍照留存),并采用经验证的方法进行含量、有关物质等反应产品质量项目的检测。对于固体样品,要注意取样的代表性,尤其是光照条件下可能不均一的剂型。
3)结果判断
在影响因素试验结束后,要评价高温、高湿、光照所引起的变化是否可接受,并根据需要采用特殊标签或包装以确保药品在货架期内符合质量标准。
2.1.2加速试验
加速试验的目的是通过加速药物的理化变化,考察药物稳定性,为制剂设计、包装、贮存和运输条件选择提供依据。
表6 制剂加速试验设计表
加速试验注意事项:
1)采用3批样品进行加速试验,采用市售包装。
2)在一般情况下,如果在加速6个月内任意时间点发生显著变化,应增加中间条件,并根据中间条件的考察结果来确定货架期。
3)对于需冷藏保存的制剂,如果在加速试验下3~6个月期间发生显著变化,应根据长期试验的实际数据确定建议的货架期,不能采用外推法;如果在前3个月内即发生显著变化,应考察短期偏离贮存条件对药物的影响,必要时,可选择一批样品进行3个月内取样更频繁的稳定性考察。
4)拟冷冻制剂应对1批样品在5℃±3℃或25℃±2℃条件下放置适当时间,以了解短期偏离标签贮藏条件对制剂的影响。
5)半渗透性容器样品应设置较低的湿度,考察样品失水情况,如发生显著变化,需增加中间条件考察,如只失水一项发生显著性变化则不必进行中间条件考察。
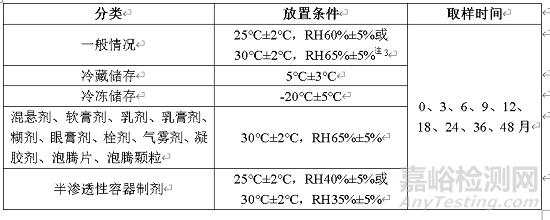
2.1.3长期试验(含中间条件)
表7 制剂长期试验设计表
注3:此条件也是中间条件
长期试验注意事项:
1)采用3批样品进行长期稳定性考察,采用市售包装
2)长期试验的条件有两个,分别为25℃±2℃,RH60%±5%或30℃±2℃,RH65%±5%选择哪个都可以,如果选择30℃±2℃,RH65%±5%的条件作为长期试验条件则3)无需再进行中间试验;如果选择25℃±2℃,RH60%±5%的条件作为长期条件,且在加速试验过程中发生了“显著变化”,则应增加中间放置条件。
3)对于半渗透性容器样品,应能证明长期条件下贮存无明显失水。
2.1.4产品使用中稳定性
产品使用中稳定性试验的目的是确定使用中的放置条件和药品开启后的使用期限,保障药品使用中的安全性。从用药安全的角度所有的制剂均应进行适当的使用中稳定性考察,尤其是需要临床前重新配制的药物(如注射粉针)、部分可研碎服用的固体口服制剂(如阿哌沙班片、替格瑞洛片)、多剂量制剂(如软膏剂、滴眼剂等)以及部分高阻隔包装的药物。产品使用中稳定性推荐在接近货架期末考察,如申报时不能覆盖则提供最近一次的测定数据。使用中稳定性考察除关注有关物质、含量等指标,还应重点关注微生物限度。
2.2稳定性承诺
创新药申报时通常长期稳定性数据还无法涵盖建议的货架期,需承诺批准后对已开展稳定性研究的样品继续进行稳定性研究,直至建议的货架期;如果申报时进行稳定性研究的样品不包括生产批次,需承诺对生产规模生产的前三批样品进行长期稳定性研究,直至建议的货架期;同时承诺对上市后每年生产的至少一批样品进行稳定性留样。
2.3稳定性数据评价
稳定性研究最重要的目的是建立所有在相似条件下生产出来的制剂样品的货架期。数据评价流程如下图:
制剂样品中与产品安全性、有效性直接相关的指标除有关物质、异构体、含量外,还包括溶出度等指标,制剂样品具体的货架期计算方法参见原料药复验期计算部分。
结束语
药物稳定性是药品的重要属性,直接关系药品安全性、有效性,是新药研发的重要内容。在开展稳定性研究之前的设计非常重要,样品是否符合要求、放置条件、考察项目和时间点设置是否合理、分析方法是否经过验证都是需关注的问题,在实际工作中,稳定性试验设计在各指导原则的框架下,可根据药物性质、剂型特点和使用方法灵活设置,重要的是要能体现药物在储存、运输、使用中的质量变化情况,能得出正确的结论。
参考文献:
[1]中国药典2020年版四部通则9001,原料药与制剂稳定性试验指导原则
[2]ICH Q1A 新原料药和制剂的稳定性试验
[3]ICHQ1B 新原料药和制剂的光稳定性试验
[4]ICHQ1E 稳定性数据评价
[5]Guidance for Industry:Stability Testing of Drug Substance and Drug Products
[6] 化学药物(原料药和制剂)稳定性研究技术指导原则