医疗器械初创公司 NURAMI MEDICAL 的电纺纳米纤维产品 ArtiFascia® Dura Substitute(一种可吸收的硬脑膜修复移植物)已获得美国食品药品管理局 (FDA) 的 510(k) 许可。下一阶段将在美国开始销售。
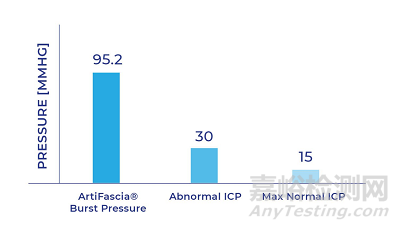
硬脑膜的防水闭合是一项重要的临床目标,尤其是在脑膜下手术中。如今,神经外科医生通常使用移植物和液体密封剂来修复硬脑膜,防止神经外科手术后出现脑脊液(CSF)渗漏。尽管如此,手术后仍有高达 30% 的泄漏几率。CSF 渗漏对患者的危害极大,可能导致长期住院,甚至需要重复手术。
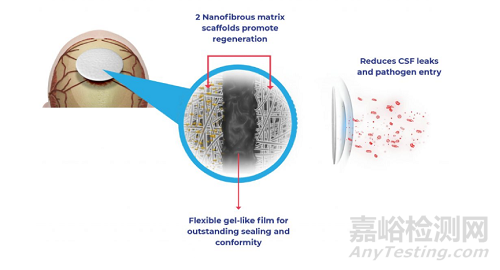
Nurami Medical 用于硬脑膜修复的 ArtiFascia® 是一种由医用合成聚合物制成的多孔纳米纤维移植物,旨在解决这一问题。该移植物含有可生物降解的纳米纤维,有助于促进硬脑膜再生,还含有对温度敏感的粘弹性无孔屏障膜,旨在防止脑脊液(CSF)渗漏。ArtiFascia® 有助于消除在移植物之外使用液体密封剂的需要,同时有助于减少 CSF 渗漏的机会,并有助于提高患者神经外科手术后的愈合和恢复。
在一项多中心关键性临床试验中,ArtiFasica® 成功地植入了 58 名患者体内,达到了所有终点指标,与植入对照组 27 名患者体内的市售替代品相比没有劣势。
神经外科手术需要更换保护大脑和脑脊液(CSF)的硬脑膜。ArtiFascia® 结合了两层电纺纳米纤维,形成仿生物支架和无孔屏障层。这种独特的结构具有双重功能:支架旨在促进硬脑膜组织再生和快速愈合,而屏障层则旨在解决缝合孔和细菌渗透造成的 CSF 渗漏问题。
ArtiFascia® 的厚度与原生硬脑膜相似,可以轻松缝合,加快了外科医生的工作流程,降低了医疗成本。该植入物坚固、柔韧、可完全吸收、合成、易于处理和切割。
美国食品及药物管理局FDA此次批准的依据是 Nurami 重要的随机临床试验。这项由 85 名患者参与的研究显示,该产品在预防 CSF 渗漏的主要终点以及其他安全性和外科医生偏好方面表现出色。
"Nurami 的联席首席执行官 Hannoch Marksheid 表示:“这是 Nurami 软组织修复现代化努力中的一个重要里程碑, ArtiFascia® 是硬脑膜修复的新型替代品,可解决手术部位危险的 CSF 渗漏和感染问题,同时促进硬脑膜再生。”
ArtiFascia®是硬脑膜修复的一种新型替代方法,可以解决手术部位危险的CSF渗漏和感染问题,同时促进硬脑膜再生。耶路撒冷哈大沙希伯来大学医院神经外科医生、前墨尔本皇家医院神经外科主任安德鲁-凯伊(Andrew Kaye)教授表示:"我们需要一种薄而柔韧的硬脑膜替代物,它可以缝合到位,不会从缝合孔渗漏,并能与周围的硬脑膜融为一体。关于 ArtiFascia®,"Nurami 的 ArtiFascia® 硬脑膜替代物恰恰具有这些特点,并在临床研究中取得了令人印象深刻的结果。植入物中的纳米电纤维有可能改变神经外科手术后硬脑膜再生的最佳状态。"
霍夫斯特拉/诺斯韦尔大学唐纳德-扎克(Donald and Barbara Zucker)医学院神经外科教授兼副主任迈克尔-舒尔德(Michael Schulder)博士强调了 ArtiFascia® 如何满足市场需求:"即使在神经外科发展了 140 年之后,我们仍然需要一种安全可靠的硬脑膜替代物来覆盖大脑。ArtiFascia® 看起来确实是我们期待已久的解决方案,它可以追溯到哈维-库欣(Harvey Cushing)的时代,甚至更早。即使是后窝手术患者,ArtiFascia® 也能可靠地封堵硬脑膜间隙,防止假性脑膜瘤的形成。"
关于Nurami Medical
Nurami Medical是一家以色列初创医疗器械公司,由纳米纤维和生物材料专家Amir Bahar博士和Nora Nseir Manassa于2014年共同创立。公司开发基于电纺纤维和先进材料的创新植入物和密封剂,以改善患者的治疗效果,提高软组织相关手术的恢复能力。Nora Nseir Manassa 和 Hannoch Marksheid 担任联合首席执行官,Amir Bahar 博士担任首席运营官、临床主任和董事会成员。