美国 FDA 药品审评与研究中心(CDER)定量药理学处处长 Hao Zhu 上个月在 DIA 全球年会上表示,结合人工智能和机器学习(AI/ML)元素的药物申请数量在过去五年内急剧增加。
他表示,2022 年 FDA 收到了 170 件包含 AI/ML 的申报材料。而 2018 年只有 3 份申报内容包含 AI/ML 内容。
AI/ML 用于支持丰富研究设计、确定研究患者、确定患者风险、选择和优化剂量、评估终点和生物标志物、预测药物毒性,或者用于药物发现或老药新用。
Zhu 举了一个例子,使用 AI 工具支持 Anakinra 的紧急使用授权(EUA),Anakinra 是一种用于治疗新冠住院患者的药物,使用机器学习模型来选择临床试验中的患者。他指出,申办人使用了两种机器学习模型来得出基于评分的患者选择规则。他表示,FDA 支持并鼓励适当使用 AI/ML 等创新工具来简化新药开发。
2022 年 6 月发表在《临床药理学与治疗学》杂志上的一篇文章题为“2016 年至 2021 年药物开发监管申报中人工智能和及其学习的应用分析”[1],审查了 2016 年至 2021 年件药品和生物制品监管申报情况,并在申报内容中搜索“机器学习”或“人工智能”等关键术语。Zhu 是文章作者之一。
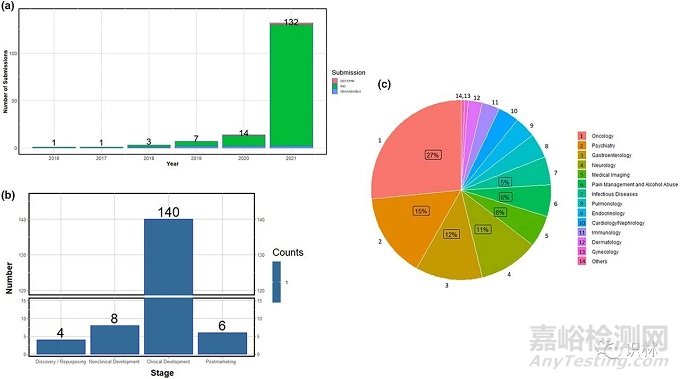
分析发现,2021 年 FDA 收到了 132 件包含 AI 和 ML 元素的新药和生物制品申请,其中,肿瘤学领域占比最多(27%),其次是精神病学领域(15%)和胃肠病学领域(12%)。大多数 AI/ML 元素最常用于临床阶段,其次是非临床、上市后以及药物发现和老药新用阶段。
(a)按年份显示包含 AI/ML 内容的申报分布情况;(b)按治疗领域显示包含 AI/ML 内容的申报分布情况;(c)按治疗药研发生命周期显示包含 AI/ML 内容的申报分布情况。
FDA 有兴趣评估公众对 FDA 应如何使用 AI/ML 来帮助指导监管审评的反馈意见。今年 5 月份,FDA 发布了两份关于在药物开发和生产中使用 AI/ML 的讨论文件,以征求反馈意见。
Zhu 表示,“CDER 将仔细审查和分析这些意见,并根据收到的反馈,FDA 将计划召开公开研讨会、制定白皮书和指南,以提供监管清晰度。”
[1] Liu, Q., Huang, R., Hsieh, J., Zhu, H., Tiwari, M., Liu, G., Jean, D., ElZarrad, M.K., Fakhouri, T., Berman, S., Dunn, B., Diamond, M.C. and Huang, S.-M. (2023), Landscape Analysis of the Application of Artificial Intelligence and Machine Learning in Regulatory Submissions for Drug Development From 2016 to 2021. Clin Pharmacol Ther, 113: 771-774. https://doi.org/10.1002/cpt.2668