背景
脑胶质瘤是神经外科治疗中最棘手的难治性肿瘤之一,胶质母细胞瘤(GBM)是最高级别以及恶性程度最高(Ⅳ级)的脑胶质瘤,占颅内原发性恶性肿瘤的45%,中国每年确诊的胶质母细胞瘤患者超过45000例,常见疗法是切除肿瘤,再采取放疗和化疗手段延长寿命。不过,胶质母细胞瘤是神经外科治疗中最棘手的难治性肿瘤之一,患者的5年生存率不到5%。
肿瘤细胞非常的狡猾,即便目前的靶向和免疫治疗已经能够非常精准有效的杀伤一部分肿瘤细胞,但是,它们还是会产生新的突变让靶向药不再起效,或者伪装自己让免疫治疗无法起效,但不管癌细胞如何变化,它都有一个最基本特征-快速恶性分裂!如果能找到一种专门靶向这些快速分裂的癌细胞的治疗方式,就能有效的杀灭肿瘤并且不会伤及我们的正常细胞。
在2000年,以色列理工学院生理学和生物物理学荣誉教授Yoram Palti博士开辟了这种全新抗癌疗法-电场治疗,并成立了Novocure公司,专门研究利用交替的低强度电场,精准的摧毁处于快速分裂的肿瘤细胞的新疗法,同时减少健康组织损伤,可很好地避免副作用影响患者生活质量。产品命名为optune,中文名爱普盾,可穿戴治疗设备。
2011年和2015年,爱普盾先后获得美国食品药品监督管理局批准,用于治疗复发和新诊断的胶质母细胞瘤(GBM)成人患者。
2020年5月,Optune顺利通过了在中国正式被国家药品监督管理局(NMPA)批准上市!用于治疗组织学证实的复发性多形性胶质母细胞瘤(GBM)的成年患者(22岁或以上),以及与替莫唑胺联合治疗新诊断胶质母细胞瘤。中文名为爱普盾。TTFields具有局部有效、全身毒副作用小、牵一发动全身的优势,但TTFields仍需继续克服其需长期佩戴、价格高且未进医保、局部皮炎不良反应等缺点。


肿瘤电场由电场发生器 (TFH9100)、电场贴片(INE9000、INE9000、WINF9020、INE9020W)电源适配器 (SPS9100) 、电池(IBH9100)、电池充电器 (ICH9100) 、连接电缆接线盒(CAD9100) 和选配件组成。可选配件:电池携带包、电场发生器携带包、电场治疗计划软件 (NovaTAL)。其中电场贴片为一次性使用,辐照灭菌,有效期9个月。
它通过体外贴敷式电极片,向体内病灶传递中频(100-300kHz)、低场强(1-3V/cm)的交变电场,破坏处于快速分裂状态的肿瘤细胞,是一种便携、低副反应的新型局部治疗方式。
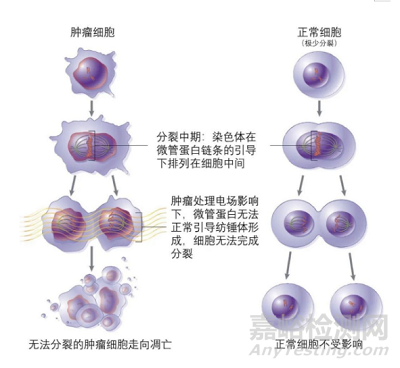
癌细胞是一群快速有丝分裂,不受控制恶性增殖的细胞。在癌细胞分裂的中期,电场影响微管蛋白聚集成簇,阻止纺锤体形成,导致染色体无法正常分离;在癌细胞分裂的末期,电场将电荷推向分裂细胞的颈部,破坏癌细胞结构。这两种作用机制导致的最终结果都是抑制癌细胞正常分裂,最终出现表面膜起泡,癌细胞破裂,死亡。
肿瘤电场现状和市场情况
多年来,胶质母细胞瘤的治疗方案更新缓慢,直至肿瘤电场治疗创新器械在中国内地获批,成为15年来我国首个胶质母细胞瘤突破性新疗法,“手术+放化疗+肿瘤电场治疗”成为新的标准治疗方案。由于肿瘤电场治疗需要长期佩戴,胶质母细胞瘤患者还需承担相对较高的治疗费用。
在国外,Optune 每个月的治疗费用是 21000 美元,主要用于购买一次性贴片。目前,Optune 在国外的收费模式是患者购买治疗疗程,支付月治疗费用,根据Novocure公司2015年披露的招股书,患者每月使用Optune费用为2.1万美金。也就是说,一个患者接受Optune治疗一年,费用高达25.2万美金,超过100万人民币。
国内上市后,单片定价约3325元,一个月大约需要使用40片,月治疗费超过13万元,可申请分期付款。通过保险的方式,部分地区可以报销60%-80%。为了提高产品的可及性,针对低保患者提供了慈善方案,低保患者可以无偿获得最多 6 盒(每盒 20 片)贴片。对于低收入患者进行分期援助,第一期自费使用 2 盒,免费获得 2 盒,后续自费使用 4 盒,可免费获得 8 盒。尽管已经推出优惠方案,但对于大多数患者而言,肿瘤电场治疗的价格依旧难以承受,如何进一步提高患者可及性依旧是肿瘤电场研发企业不得不面对的问题。另一方面,肿瘤电场治疗对于患者的依从性要求很高,患者每天都需要连续佩戴电极贴片18小时以上,佩戴时间越长效果越好,睡觉也不能摘下。由于极片需要产生电场,而此过程中也会产热,高时可达41℃,如果耐受不好的话很容易出现皮肤损伤,这也是实际使用中最常出现的副作用。虽然皮损和脑肿瘤比起来轻得多,还可通过糖皮质激素软膏等方式进行缓解,不过相同位置的皮肤短期内便不能再贴附极片,移动位置则会影响电场的覆盖区域,从而影响治疗效果。
肿瘤电场发展趋势
一方面,除了胶质瘤,如今肿瘤电场治疗有四个重要的实体瘤适应症正在研发进程中,包括联合吉西他滨治疗胰腺癌;联合多西他赛或免疫检查点抑制剂治疗肺癌;序贯标准立体定向放射治疗(SRS)治疗非小细胞肺癌造成的脑转移;联合紫杉醇治疗卵巢癌。针对中国人高发的胃肠道肿瘤的临床试验也在筹划中。
另一方面,处于十亿美金的风口。据西格玛医学内部数据显示,国内一些新创企业也正在陆续开展临床试验中或者处于试验结束阶段。江苏海莱新创,湖南安泰康成,深圳等多家企业的研发,突破专利及生产壁垒。预计未来几年,市场至少有 3-4家的企业及产品上市。南京西格玛医学作为临床研究的 CRO 公司,在方案设计,临床操作,数据管理和统计分析方面,积累了丰富的经验。
临床试验方案设计举例
一、试验目的:评价肿瘤电场治疗仪用于新诊断幕上胶质母细胞瘤治疗的有效性和安全性临床试验
二、入选标准:
1.经组织学/分子病理学确诊的新诊断幕上胶质母细胞瘤(WHO IV级)或星形细胞瘤(WHO IV级)患者(包括单发和多发病灶,分级依据2016年WHO中枢神经系统肿瘤分类与分级标准或cIMPACT-NOW update5);
2.肿瘤切除术(包括全切、部分切除、活检)后6周内(≤6周)开始同步TMZ放化疗,目前已完成肿瘤切除术和同步TMZ放化疗(约60Gy);
3.自愿参加本临床试验,并已签署知情同意书。
三、排除标准:
1.体内已有或需使用电子植入物者,包括但不限于心脏起搏器、植入型心律转复除颤器、胰岛素泵、脑部刺激器、脊髓刺激器、迷走神经刺激器等;
2.基线检查时有以下表现者:
(1)血小板减少症(血小板计数<80×10^9/L);
(2)中性粒细胞减少(中性粒细胞绝对计数<1.0×10^9/L);
(3)CTCAE4级非血液学毒性(脱发、恶心、呕吐除外);
(4)显著的肝功能损害(AST或ALT>正常上限的3倍);
(5)总胆红素>正常上限的2倍;
(6)显著的肾脏损害(血肌酐>1.7 mg/dL)。
3.合并急性重症感染;
4.合并严重的心功能不全者;
5.CT或MRI等影像学检查有明显颅内压升高表现(如中线结构移位超过5mm,有临床意义的视神经乳头水肿,呕吐,恶心或意识水平下降);
6.替莫唑胺过敏史;年龄18-65 岁的患者, 性别不限。要求患者无严重心、肝、肾及血液系统合并症,无严重并发症及严重全身感染,无急性代谢紊乱,无严重免疫系统疾病,伴有糖尿病者须控制血糖≤10mmol/L且保持该水平2周以上。排除妊娠、哺乳期妇女和对银有过敏史者,排除依从性差或生命垂危及不能完成疗程者。
四、主要指标:无进展生存期。







