今日头条
同源康小分子CDK7抑制剂获批临床。同源康医药自研新一代小分子CDK7抑制剂TY-2699a获FDA临床许可,拟用于治疗多种晚期肿瘤,如乳腺癌、卵巢癌、前列腺癌、胰腺癌、小细胞癌及血液瘤等。在临床前研究中,TY-2699a已在多个瘤种中显示出良好的抑制作用,而且具有良好的安全性。目前,该公司计划尽快提交TY-2699a的国内临床试验申请。
国内药讯
1.武田CMV口服疗法拟纳入优先审评。武田新机制抗病毒疗法马立巴韦片的上市申请获CDE拟纳入优先审评,拟用于治疗移植后巨细胞病毒(CMV)感染/疾病,且使用过更昔洛韦、缬更昔洛韦、西多福韦或膦甲酸钠难治(伴或不伴基因型耐药)的成人患者。Livtencity通过抑制CMV病毒的pUL97蛋白激酶,阻断病毒的复制。该新药为首款且唯一一款获FDA批准针对这类患者的口服疗法。
2.罗氏抗儿童流感新药拟纳入优先审评。罗氏玛巴洛沙韦干混悬剂的上市申请拟纳入优先审评,拟用于儿童单纯性甲型和乙型流感患者。玛巴洛沙韦是一款具有创新作用机制的帽状结构依赖性核酸内切酶抑制剂,也是获批治疗流感的首个单剂量口服药物。2021年4月,玛巴洛沙韦片在中国获批上市,用于治疗12周岁及以上急性无并发症的流感患者。
3.维立志博MUC16/CD3双抗获批临床。维立志博1类新药注射用LBL-033获国家药监局临床试验默示许可。LBL-033是一种T细胞连接器,可同时靶向并结合表达MUC16的肿瘤细胞和表达CD3的T细胞,介导T细胞对MUC16阳性肿瘤细胞的特异性杀伤,同时促进免疫细胞因子的分泌,具协同抗肿瘤潜力。该新药拟开发用于治疗MUC16阳性恶性肿瘤。
4.百吉自体T细胞疗法获批鼻咽癌临床。百吉生物基因修饰T细胞疗法BRG01注射液获FDA临床许可,拟开展用于治疗复发/转移性鼻咽癌的Ⅰ/Ⅱ期临床。BRG01是一款靶向EB病毒(EBV)抗原的自体T细胞免疫治疗产品,已于去年年底在国内获批开展用于末线治疗复发/转移性EBV阳性鼻咽癌的临床研究。百吉生物计划在中国、美国、新加坡三地同步开展Ⅰ/Ⅱ期国际多中心临床试验,为新药未来的全球商业上市奠定基础。
5.石药TNFR2单抗国内获批临床。石药集团旗下新石生物TNFR2单抗1类新药NBL-020注射液获国家药监局临床试验默示许可,拟单药或联合标准治疗用于治疗晚期恶性肿瘤,包括但不限于肺癌、结肠癌、卵巢癌、乳腺癌以及皮肤T细胞淋巴瘤等。临床前研究显示,NBL-020单药或与PD-1抗体联用,均具有积极的抗肿瘤活性和良好的安全性。去年12月,该新药已在美国获批开展治疗晚期实体瘤的临床试验。
国际药讯
1.辉瑞PARP抑制剂治疗mCRPC的III期临床积极。辉瑞在ASCO GU 2023会议上公布PARP抑制剂Talzenna(talazoparib)联合恩扎卢胺一线治疗转移性去势抵抗前列腺癌(mCRPC)的III期TALAPRO-2研究最新数据。与安慰剂相比,Talzenna使患者的疾病进展或死亡风险降低37%(P<0.001)。目前Talzenna组患者仍未达到中位rPFS,而安慰剂组患者的中位rPFS为21.9个月。FDA已授予Talzenna针对mCRPC适应症的上市申请优先审评资格。
2.SORD缺陷疗法Ⅲ期临床积极。Applied公司具CNS渗透性的醛糖还原酶抑制剂AT-007(govorestat)治疗SORD缺陷(遗传性轴突神经病变)的Ⅲ期研究INSPIRE结果积极。SORD缺陷由山梨醇脱氢酶基因突变引起,山梨醇的高水平积聚将导致运动神经元变性,从而使患者丧失运动能力。90天治疗结果显示,AT-007使患者的血液山梨醇水平平均减少52%(大约16000ng/ml),较安慰剂组有显著差异(p<0.001);药物总体耐受性良好。
3.武田Bcr-Abl激酶抑制剂Ⅲ期临床积极。武田Bcr-Abl激酶抑制剂泊那替尼(ponatinib)联合化疗治疗费城染色体阳性急性淋巴细胞白血病新确诊患者的Ⅲ期临床(PhALLCON)达到主要终点。与伊马替尼(imatinib)联合化疗相比,ponatinib组合使患者达到微小残留病灶(MRD)阴性完全缓解的比例更高(34.4%vs16.7%,p=0.0021),其中位无事件生存期也呈现改善趋势(HR=0.652,95% CI:0.385-1.104)。两组的治疗伴发不良反应(TEAE)率相似。详细数据公布于ASCO会议上。
4.歧化酶类小分子新药获FDA优先审评。Galera公司小分子歧化酶模拟物avasopasem的新药申请(NDA)获FDA受理,用于治疗接受标准治疗的头颈癌(HNC)患者因放疗引起的严重口腔粘膜炎。FDA同时授予其优先审评资格,PDUFA日期为2023年8月9日。Ⅲ期试验ROMAN和Ⅱb期试验GT-201的汇总数据显示,avasopasem显著降低了患者的SOM疾病负担关键性指标(包括SOM发生率和天数、SOM严重程度等),而且不影响标准放化疗的治疗效果。
5.安博PSMA-ADC晚期前列腺癌早期临床积极。Ambrx Biopharma公司靶向前列腺特异性膜抗原(PSMA)的抗体偶联药物(ADC)ARX517治疗晚期前列腺癌经治患者的Ⅰ期临床(APEX-01)结果积极。与基线相比,ARX517(2.0mg/kg)降低队列6患者(n=3)的前列腺特异性抗原(PSA)水平超过50%,其中2例患者PSA水平下降程度超过90%;临床中无药物相关严重不良反应(SAE)或≥3级的治疗相关不良反应,ARX517总体耐受性良好。
6.细胞外蛋白降解药物公司完成新融资。专注于细胞外蛋白降解的Avilar 公司宣布获得新投资者的支持,目前已完成总金额7500万美元融资。Avilar Therapeutics正在开发一类被称为ATAC(ASGPR Targeting Chimeras)的新型蛋白质降解剂,以用于治疗由致病性细胞外蛋白驱动的自身免疫疾病、神经疾病和其他疾病。ATAC是一种双功能分子,由能与肝脏细胞表面表达的去唾液酸糖蛋白受体(ASGPR)结合的配体和能与致病性细胞外蛋白结合的另一种配体组成。
医药热点
1.5类互联网诊疗行为将被扣分。江苏省苏州市修订印发《医务人员不良执业行为记分管理办法》,将于3月1日起施行。新《办法》增加互联网诊疗等相关记分条款,明确5类“云服务”将被扣分,分别是:对首诊患者开展互联网诊疗活动;互联网诊疗中违反规定开具麻醉药品、精神药品等特殊管理药品处方;未经电子实名认证或未满3年独立临床工作经验开展互联网诊疗活动;未经其执业注册的医疗机构同意开展互联网诊疗活动;未经批准利用互联网开展诊疗活动。
2.国家医保局推进药店购药可报销。日前,国家医疗保障局发布《关于进一步做好定点零售药店纳入门诊统筹管理的通知》。《通知》指出,各级医保部门要采取有效措施,鼓励符合条件的定点零售药店自愿申请开通门诊统筹服务,为参保人员提供门诊统筹用药保障。参保人员凭定点医药机构处方在定点零售药店购买医保目录内药品发生的费用可由统筹基金按规定支付。
3.中华医学会罕见病分会在京成立。2月19日下午,中华医学会罕见病分会成立大会在北京隆重召开。会议选举产生第一届委员会常务委员、副主任委员和主任委员。北京协和医院院长、心内科教授张抒扬当选第一届主任委员。张抒扬表示,分会成立后,紧锣密鼓即将开展的工作包括组织罕见病专业培训,加强罕见病学术交流,不断培养壮大能诊能治的罕见病医师队伍;组织专家团队编写指南,优化临床路径,提高罕见病规范诊断和治疗水平。
4.上海百汇医院开业试运营。2月18日,新虹桥国际医学园区内唯一的中外合资综合医院——上海百汇医院开业试运营。上海百汇医院一期总投资16.1亿元人民币,建筑面积84,400平方米,可设置近500张床位。一期开设42间内科及专科诊室,66间病房、VIP套房,百级、千级、万级层流手术室,可提供门诊、手术、住院服务,并设有24小时医疗服务。值得一提的是,该院首批开展的业务包括全国呼吸专家白春学教授领衔的“元宇宙肺结节诊治和健康管理中心”。
评审动态
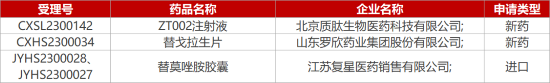
1. CDE新药受理情况(02月20日)
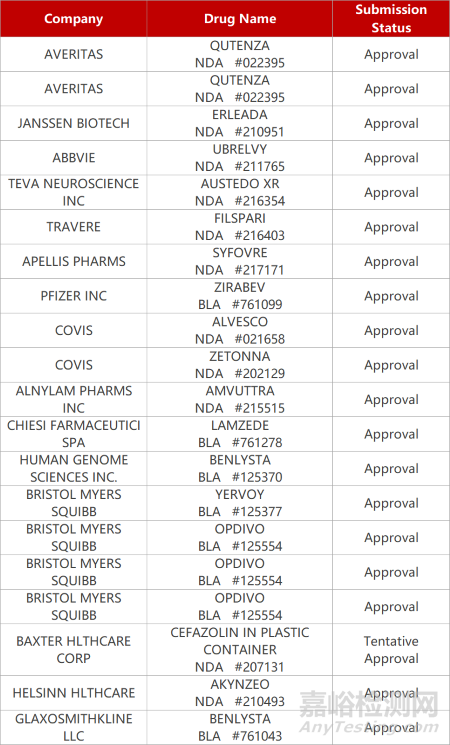
2. FDA新药获批情况(北美02月17日)