您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-28 15:09
作为挤出式生物打印技术的一种变体,微流控同轴生物打印技术可以通过多层喷头同步挤出多种生物墨水、交联剂等组分,特别适用于构建单层或多层的中空管状结构,近年被广泛应用于组织工程化人工血管的构建研究中。然而,目前同轴生物打印的人工血管尚难以同时具备优异的机械性能和仿生功能等特征。在已有的研究基础(如Advanced Materials, 2018, 30, 1706913)上,哈佛医学院Y. Shrike Zhang教授课题组联合麻省理工学院赵选贺教授课题组设计了一种基于海藻酸盐和明胶天然聚合物的高细胞相容性强韧双网络水凝胶,用于高通量微流控同轴生物打印功能化的单层及双层中空血管组织,以分别模拟天然静脉及动脉,实现了解剖结构、机械性能及重要血管功能的仿生。
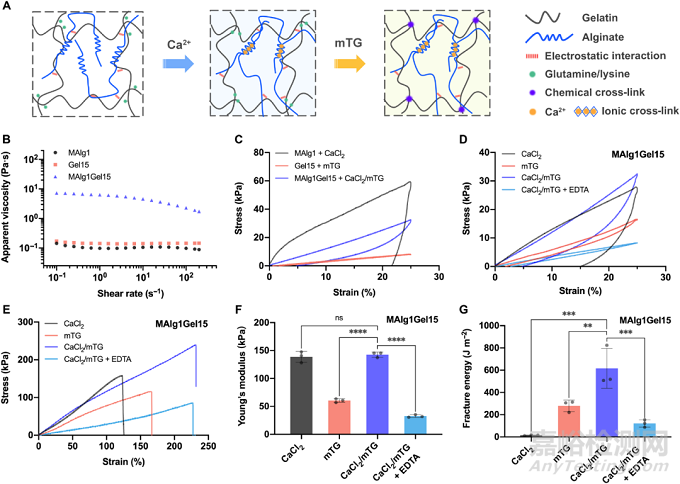
图1. 坚韧天然双网络水凝胶生物墨水的设计与机械性能表征
此双网络水凝胶通过Ca2+物理交联的海藻酸盐形成第一级网络,以微生物转谷氨酰胺酶(mTG)化学交联的明胶 (gelatin)(或明胶甲基丙烯酰(GelMA))形成第二层网络,原材料均为天然聚合物,且mTG为FDA批准的酶,整体生物相容性相比于传统双网络水凝胶较佳。海藻酸盐和明胶之间存在强静电作用,在0.1 s-1剪切速率下,两者混合水凝胶溶液的表观粘度为单组分的40倍。在双网络水凝胶中,第一级网络由致密可逆离子交联形成,大幅度提升了水凝胶的刚度与能量耗散的能力;第二级网络由酶引发的稀疏共价交联组成,赋予了水凝胶良好的弹性和柔性。因此,该双网络水凝胶表现出了优异的机械性能,相对于单组分水凝胶,它具有更高的强度和可拉伸性。此外,其高效的能量耗散机制和强化的可拉伸性赋予了水凝胶出色的断裂能(616.3 J·m-2)。
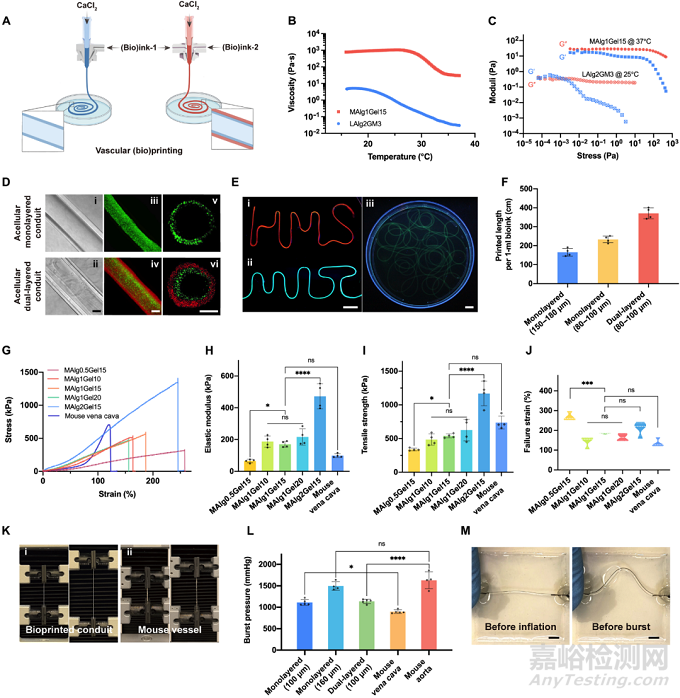
图2. 微流控同轴挤出式生物打印中空导管及其机械性能表征
研究者分别利用定制化的双通道和三通道同轴喷头,以此水凝胶前体溶胶为生物墨水,打印单层和双层中空管状结构。打印过程中,外层挤出的墨水,在芯层CaCl2流动相辅助下形成快速离子交联,而得到中空管状结构。打印后,中空管进一步在CaCl2/mTG溶液中后交联,形成双网络水凝胶。单层导管壁和双层导管内层管壁的水凝胶由中粘度海藻酸盐(MAlg)及明胶组成(Bioink-1),以提供细胞粘附与形成强韧力学支撑。而双层导管外层管壁水凝胶由低粘度海藻酸盐和GelMA组成(Bioink-2),用以支持细胞活动。研究者使用多种配方组合成功高通量打印两种导管(海藻酸盐为0.5-2 wt%,明胶为10-20 wt%,GelMA为1-5 wt%),表现出了广泛的打印调节性(管壁和管径可调节范围大)和良好的可打印性(各材料组合经打印参数调节后均可成功打印成管)。研究者将打印后的导管通过外科结结扎固定在定制的生物反应器中,进行24小时持续灌注、渗透实验,结果证明,单、双层导管均具有良好的可灌注性和选择性渗透能力。与哈佛医学院C. Keith Ozaki教授课题组合作,以小鼠的天然主动脉和腔静脉为对照组,对各组导管进行机械性能表征,结果证明MAlg1Gel15等配比的导管在爆破压力、刚度、强度及断裂应变等参数上,与天然对照组无显著性差异。值得注意的是,相对于水凝胶膜片,挤出的水凝胶在剪切力诱导的分子链取向重排作用下,表现出了更高的模量和强度。
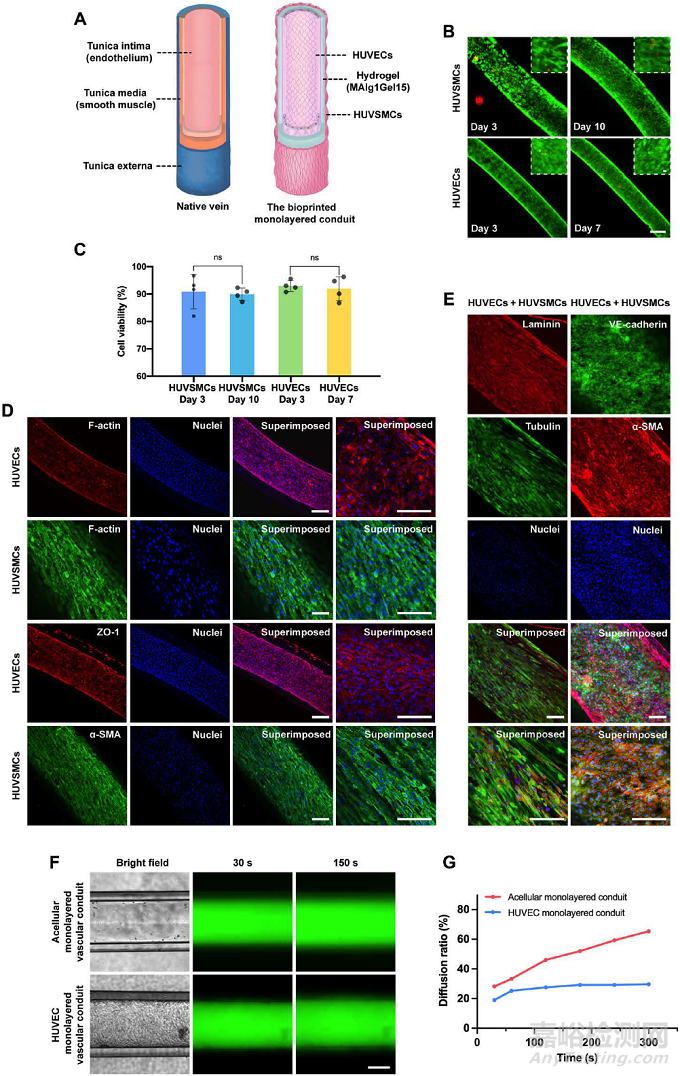
图3. 微流控同轴挤出式生物打印人工静脉的结构及生物学功能表征
研究者在单层导管管腔内和管壁外分别接种薄层的静脉内皮细胞和平滑肌细胞以模拟天然静脉,内皮细胞通过注射器腔内推注细胞悬液完成接种;至于平滑肌细胞的接种,研究者则是将打印后的单层导管置于特定的凹陷疏水模具中,使细胞选择性地贴附在亲水性的水凝胶管壁外,最终两种细胞分别在管壁内、外实现了密集的粘附,解决了细胞难以接种于水凝胶管壁的难题,细胞活死实验表明单层导管的细胞相容性优异。免疫蛋白荧光染色证明,内皮细胞间存在紧密的细胞间连接以保证内皮细胞发挥相关功能,并活跃合成层粘连蛋白;平滑肌细胞表达出了致密的α-平滑肌肌动蛋白和微管蛋白,染色结果证实了人工血管腔内功能性内皮层和外壁平滑肌层的形成。类似于天然血管,人工血管内表面的内皮层作为血管屏障,在控制生物分子、营养物质和细胞的外渗方面发挥着关键作用。渗透性实验表明,含有内皮细胞层的人工静脉有效的延迟了荧光分子的外渗速度,发挥了内皮层的功能。
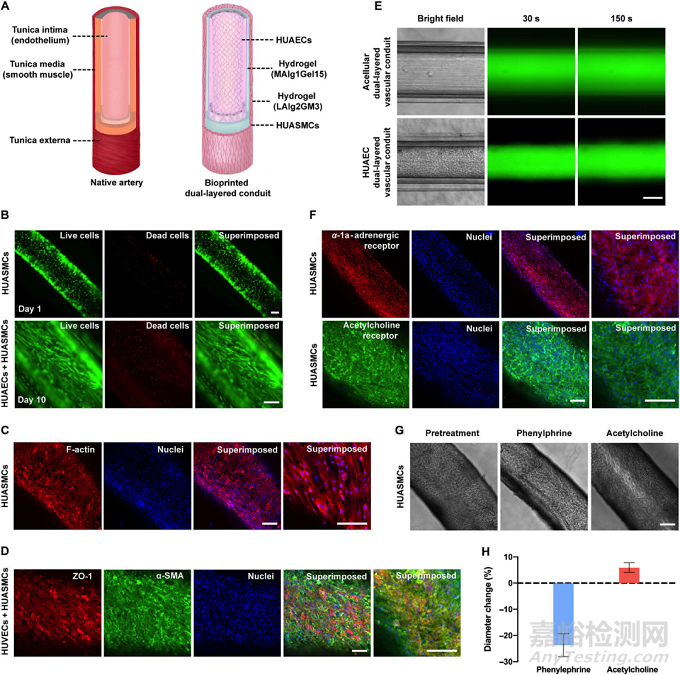
图4. 微流控同轴挤出式生物打印人工动脉的结构及生物学功能表征
由于需要承担耐受高血压及调节血压等重要功能,动脉具有明显比静脉更厚的平滑肌层。为了仿生这一解剖结构特征,人动脉平滑肌细胞悬于外层水凝胶前体溶胶(Bioink-2)中,进行负载人动脉平滑细胞(HUASMCs)的直接生物打印(内层仍为提供主要机械性能的Bioink-1),打印后向腔内灌注接种人动脉内皮细胞,活死细胞实验表明经直接生物打印的HUASMCs 存活率高。组织学染色和渗透实验表明,相比于人工静脉类,人工动脉在管腔内形成相似的具有屏障功能的致密内皮层,同时具有更厚的外层平滑肌层。特别地是,由于厚平滑肌层的存在,人工动脉表现出了明显的药物刺激响应的血管活动性,即在去氧肾上腺素的作用下,血管发生明显收缩,而接下来经过乙酰胆碱的处理后,收缩的血管逐渐恢复原有尺寸,并进一步舒张。因此人工动脉较好地仿生了天然动脉的重要生理功能。
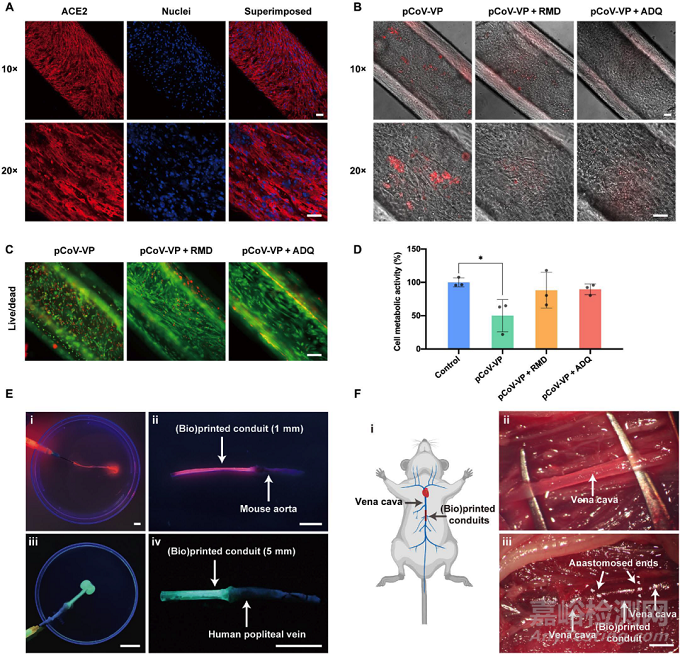
图5. 微流控同轴挤出式生物打印人工动脉的体外、离体及体内应用
通过体外、离体及体内实验,该人工血管表现出了作为临床前体外器官模型和体内组织移植物的应用潜能。作为体外模型应用上,研究者通过SARS-CoV-2伪病毒(pCoV-VP)感染来研究人工血管的直接反应,并采用两种临床批准用于COVID-19的抗病毒药物瑞德西韦 (RMD) 和阿莫地喹 (ADQ) 处理感染后的血管,以观察抗病毒药物的有效性。pCoV-VP 感染前的染色表明,接种于人工血管的平滑肌细胞和内皮细胞高表达了SARS-CoV-2感染的关键受体—ACE2。病毒处理后实验表明,人工血管容易受到SARS-CoV-2感染,并且在抗病毒药物存在的情况下,pCoV-VP 的细胞病变作用降低,细胞活性和代谢活性明显提高。为了探索该生物打印的人工血管做为组织移植物的潜力,研究者分别进行和离体和体内吻合实验。首先,通过不同管径的人工血管分别与直径约1 mm的离体小鼠主动脉和直径约5 mm的离体人静脉通过组织胶水进行吻合,并灌注以荧光染料,观察到染料流通通畅,在吻合口处或血管壁处均未发现泄漏;其次 ,在活体小鼠中,将人工血管移植至小鼠腔静脉断端,打开血管夹后,发现血流流通通畅无泄漏,因此初步证明了其作为组织移植物的可能性。
该文章以"Microfluidic Bioprinting of Tough Hydrogel-based Vascular Conduits for Functional Blood Vessels"为题发表在Science Advances上。哈佛医学院/北京协和医学院联合培养博士王迪(现为中国医学科学院整形外科医院医生)、哈佛医学院博士后Sushila Maharjan、哈佛医学院博士后匡晓为本文的共同第一作者,主要通讯作者为哈佛医学院Y. Shrike Zhang教授,共同通讯作者为麻省理工学院的赵选贺教授和哈佛医学院的C. Keith Ozaki教授,其他共同作者包括Zixuan Wang、Luis S. Mille、Ming Tao、Peng Yu、Xia Cao、Liming Lian、Li Lv、Jacqueline Jialu He、Guosheng Tang及Hyunwoo Yuk。

来源:高分子科技


