您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-10-17 02:20
摘 要Abstract
药品监管质量管理规范(GRP)建设,是增强药品监管部门执行力公信力、提升药品全生命周期管理能力、降低药品技术性贸易壁垒和推动药品监管职能转变的制度基础。基于我国GRP 实施现状、国际组织互认协议和部分地方政府监管体系等比较分析,本文对GRP 体系的分类与原则、建设内容和制度框架进行开拓性研究,提出GRP 建设的国际互认协议、协调层级、地方制度创新、市场监管卫生健康制度移植和数字化流程再造等原则,以及基于组织协调、工作流程、专业知识的GRP 建设霍尔三维空间结构, GRP 规范/ 指南编制的综合评价方案。
The construction of Good Regulatory Practice (GRP) is the institutional basis for enhancing the executive power and credibility of government, improving the ability of drug life cycle management, reducing drug technical trade barriers, and promoting the transformation of drug regulatory function. Based on the comparative analysis of implementation status of GRP, mutual recognition agreements of international organizations, and supervision systems from several countries, this paper conducted the pioneering research on the classification and principle of GRP system, construction content, and construction framework, and proposed the principles of GRP construction, e.g. the international mutual recognition agreement, government coordination level, local regulatory innovation, system transplantation about market administration and health administration, and the digital process reengineering. Especially this paper studied the Three-dimensional Space Structure of GRP construction based on the organizational coordination, work flow, and the professional knowledge, and put forward the comprehensive evaluation solution for the formation of GRP standard/guideline.
关键词Key words
药品监管质量管理规范;原则;框架;世界卫生组织
Good Regulatory Practice (GRP); principle; framework; World Health Organization
基金项目
2021 年中国药品监督管理研究会课题:药品监管质量管理规范(GRP)建设原则和框架研究
《药品监管质量管理规范》(Good Regulatory Practice,GRP)建设原则和框架,是世界卫生组织(WHO)2021 年4 月发布《医药产品监管质量管理规范》(Good Regulatory Practice for Medical Products)和《医药产品监管互信质量管理规范》(Good Reliance Practice for Medical Products) 的主要内容。《“十四五”国家药品安全及促进高质量发展规划》提出“深入参与国际监管协调”“强化多部门治理协同”等药品安全治理体系建设要求。2017 年6月,我国加入国际人用药品注册技术协调会(ICH)。2021 年9 月,国家药品监督管理局启动药品检查合作计划预加入申请工作,对加速我国药品监管体系标准融入国际组织互认协议进程, 参与国际医药治理具有里程碑意义。对于探索适合我国国情的GRP 制度建设,助力增强政府部门执行力公信力、增进国际药品监管机构合作、推进医药产业高质量发展和提升药品监管体系和监管能力现代化水平具有重大意义。
1 我国GRP 实施现状分析
1.1 GRP 概述和我国GRP 体系基础
保障药品质量和安全,不仅仅属于医药企业质量安全体系范畴, 更是强化药品监管体系规范的工作重点。2021 年4 月,WHO 发布《医药产品监管质量管理规范》《医药产品监管互信质量管理规范》,明确“监管体系是用来描述机构、流程、监管框架和资源的结合”,并提出医疗产品国家监管体系评估全球基准工具(GBT)。党的十八大和十九大以来的“放管服”和“机构编制法定化”等改革政策,增进政府机构的职能优化、协同高效,推进了药品监管工作合规性建设进程。依据《国家药品监督管理局职能配置、内设机构和人员编制规定》(三定方案)[1],国家药品监管部门负责标准管理、注册管理、质量管理、上市后风险管理等职责;《国务院关于加强和规范事中事后监管的指导意见》更加明确“分领域制订全国统一、简明易行的监管规则和标准”。《国务院办公厅关于全面加强药品监管能力建设的实施意见》提出“随着改革不断向纵深推进,药品监管体系和监管能力存在的短板问题日益凸显”,并明确“对标国际通行规则”“深入参与国际监管协调机制,积极参与国际规则制定”等政策要求。
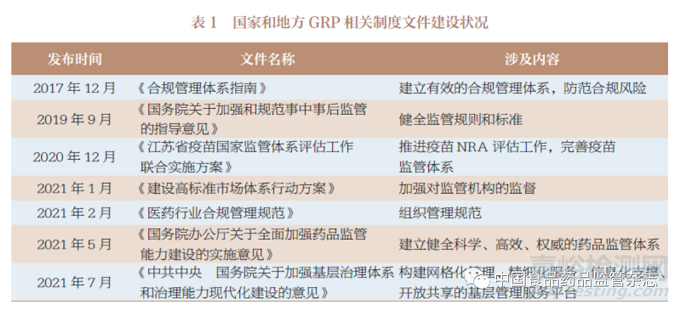
药品质量安全,不仅依赖于企业质量管理体系, 更依赖于GRP 的建立与完善,并将追溯管理、药物警戒制度等融入药品监管科学体系。2019 年新修订《药品管理法》确立了药品上市许可持有人(MAH)制度和网络药品销售新业态的规制;《中共中央 国务院关于开展质量提升行动的指导意见》明确“实施药品、医疗器械标准提高行动计划,全面提升药物质量水平”。近年来,我国药品监管部门牵头和主导的药品医疗器械审评审批制度改革,打击生产销售假药劣药,召开疫苗管理等部际联席会议,推进了我国GRP 建设进程。国家和地方GRP 制度文件的制修订,推进了我国GRP 体系建设进程(表1)。
1.2 我国药品GRP 进程中存在的问题
2018 年国务院机构改革、“放管服”改革纵深推进和产品备案管理等,推进了药品监管体制机制改革和职能转变,但配套的药品监管技术尚未跟进,高水平监管人员随着机构的变动流失量大,新进入的监管人员缺乏系统的专业知识和管理经验[2]。董作军等[3]认为我国《药品生产质量管理规范》(GMP)在文本上已经同发达国家相近,但实施效果同发达国家相比还存在差距,存在的问题包括对监管理念认识不深、法规和指南协调性待加强、各省检查机构管理不统一、检查员专职化程度不高、内外部监督不足和惩处不够完善等问题。首先,药品审评审批和行政许可的相关事项实施备案,是GRP 框架设计过程中需要考虑的因素。例如,临床实验基地和临床试验项目采用备案的方式,并不是放松事前监管,而是落实“放管服”、优化营商环境政策和强化事中事后监管,落实企业主体责任。其次,2021年5 月,《药品检查管理办法(试行)》合并了许可检查、GMP 检查、《药品经营质量管理规范》(GSP)检查等,但是仍未将《药物警戒质量管理规范》(GVP)检查列入以上检查管理办法。再者,药品监管系统的组织结构方面,例如风险沟通仍存在着舆情监测属于办公室、投诉举报归口市场监管部门、科普宣传归口新闻宣传部门、信访工作归口办公室或者监察室等多部门情形。
新业态新商业模式GRP 推进方面,新修订《药品管理法》确立了“设置或者指定的药品专业技术机构”,承担依法实施“审评、检验、核查、监测与评价等工作”,但当前的药品监管工作中很少有第三方机构参与药品监管法定事项。首先,当前与MAH相关的合同外包组织形式(CxO)新业态新商业模式,包括合同研究组织(CRO)、合同生产组织(CMO)、合同销售组织(CSO)、合同定制生产组织(CDMO),以及药物警戒第三方服务等机构,均未直接纳入到药品监管部门的监管范畴,仅仅依赖于临床实验数据、数据可靠性、药品安全风险等延伸检查中实施监管工作。其次,CMO 的C 证(C 代表接受委托的药品生产企业)颁发也是与MAH 的B 证(B 代表委托生产的MAH)绑定的,在MAH新业态委托业务运营中未能形成良好的市场竞争环境。再次,如何规制网络药品销售行为和构建网络销售药物警戒制度,是新技术新业务新商业模式的“三新”业态监管体系建设需要考虑的问题。
1.3 国家和地方GRP 制度建设的探索
我国GRP 体系探索和建设进程,首先体现在药品监管部门的规范性文件中。例如,《药品注册管理办法》和《药品生产监督管理办法》修改的主要内容包括[4] :一是全面落实MAH 制度,负责药品全生命周期管理;二是优化审评审批工作流程,将原来的审评、核查和检验由“串联”改成“并联”,设立突破性治疗药物、附条件批准、优先审评审批、特别审批4 个加快通道等;三是落实全生命周期管理要求,增加对药物非临床研究机构、药物临床试验机构的监管以及药品安全信用档案的相关要求;四是强化责任追究,严厉打击数据造假等违法违规行为,营造良好创新环境等。
药品安全基层监管受资源匮乏、非标准化市场结构、条块与部门权益分割等诸多限制因素,制约了事中事后监管的实际效能[5]。近年来,药品监管部门进行了监管体系规范的地方性实践探索(表2)。2016 年以来,浙江省组织开展“三网六体系”(三网:安全责任网、电子监管网、社会共治网,六体系:监管执法、风险防控、应急处置、技术支撑、标准法规、社会监督)的全方位监管方式探索。当前基层药品监管职责归口市场监管基层机构。例如,2020 年沈阳市将药品经营许可证、医疗器械经营许可证、食品经营许可证、第二类医疗器械经营备案凭证等许可证合并为行业综合许可证,反映了药品监管基层改革的趋势和方向。再如,山东、广东和北京等省市探索医疗器械许可、药品许可,以及化妆品许可合并为统一行政许可等。当前,我国麻醉药品和一类精神药品实行全产业链全方位的“计划式、垂直闭环式、集体责任和管量管价”的管制模式,是我国的成功监管实践经验①。依照《药品管理法》《禁毒法》《麻醉药品和精神药品管理条例》相关规定,国家和地方政府各部门在各个环节中承担着重要的职责,齐抓共管,各环节有主有从,形成了计划式、垂直闭环式、全产业链、全业态、全品种的管控模式,有效杜绝了麻醉药品的非法流弊和药物滥用。

2 GRP 国内外制度比较
2.1 我国加入国际组织互认协议概述
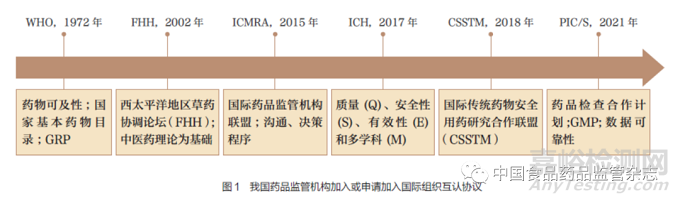
世界各国或地区在药品审批、注册、上市流通的标准和体系上存在较大差异,影响了医药产品贸易发展。基于国别之间监管体系不同的情形,WHO 于2021年4 月发布《医药产品监管质量管理规范》《医药产品监管互信质量管理规范》,通过加入ICH、国际药品检查组织(PIC/S)、世界贸易组织(WTO)国际互认协议,有助于消除药品贸易中的障碍,促进国际GMP 法规标准及检查质量的一致化。我国于1972 年5月恢复WHO 的合法席位,尤其2015 年以来,药品监管国际化进程加快;2015 年6 月正式加入国际药品监管机构联盟(ICMRA),2017 年6 月加入ICH,2021 年9 月预加入申请PIC/S 国际组织(图1)。我国药品监管部门以加入国际组织方式实施GRP 建设并进行制度移植,一方面满足了医药对外贸易快速发展中国际组织互认的需求,另一方面可降低药品监管制度变迁的成本和相应改革风险。
2.2 WHO 、ICH 和PIC/S 等相关监管体系
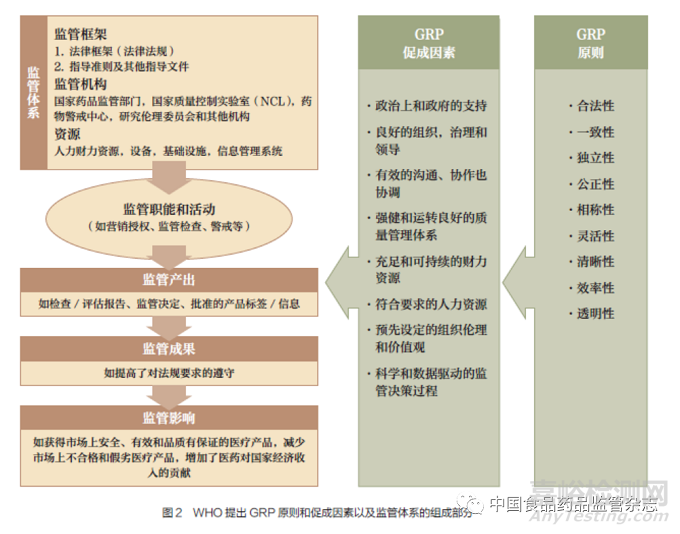
我国先后与WHO 共同制定了《世界卫生组织在中国的国家合作战略:2004-2008 战略优先事项》《中国- 世界卫生组织国家合作战略(2008-2013)》《中国- 世界卫生组织国家合作战略(2013-2015)》《中国- 世界卫生组织国家合作战略(2016-2020)》等文件,确立了我国与WHO 中长期合作重点领域及方向[6]。2021 年4 月,WHO 第55届药物制剂规范专家委员会(ECSPP)技术报告1033 号(TRS1033)中以附件10 和附件11 的形式正式发布《医药产品监管质量管理规范》《医药产品监管互信质量管理规范》,并提出GRP 九大原则和六项实施措施(图2)。
ICH 于1991 年召开第一届会议,由欧盟、美国及日本发起,并由三方成员的药物管理当局以及制药企业管理协会共同组成,2015 年10 月正式更名为国际协调理事会(the International Council for Harmonisation),其包括质量(Q)、安全性(S)、有效性(E) 和多学科(M) 四项指导原则体系。PIC/S 成立于1995 年11 月,其宗旨是以统一的标准实施药品GMP 认证,各成员相互承认官方GMP 认证报告,以降低药品流通的非关税贸易壁垒,节省人力、时间和物质成本[7]。PIC/S 设立6 个工作组,分别是原料药,计算机化系统,GSP,人体血液、组织、细胞和前沿药品(ATMPs),质量风险管理,《药物临床试验质量管理规范》(GCP)和GVP 工作组[8],旨在促使检查员在GMP 领域交流信息、起草指南文件,并提供培训机会。ICMRA 是由全世界不同地区的29 个药品监管机构组成,WHO 是其观察员,随着科技的进步,设立标准,推进决策程序,维持有效的监管,从而支持创新医药产品的研发,同时确保其收益超过相关风险。2021 年8 月,ICMRA 发布协调药品全球追溯跟踪体系的框架建议,概述了监管机构和行业如何建立全球协调统一的追溯跟踪体系,监管机构可以跟踪整个供应链中的产品。
目前国际上公认的三大国际标准组织包括国际标准化组织(ISO)、国际电工委员会(IEC)和国际电信联盟(ITU), 被称为“技术联合国”,是参与全球治理、促进国际贸易的重要切入点。ISO 于2014 年发布ISO 19600《合规管理体系指南》,我国GB/T 35770—2017《合规管理体系指南》提出,建立、发展、实施、评估、维护和改进的合规管理体系。WTO 以《与贸易有关的知识产权协定》(Agreement on Trade-Related Aspects of Intellectual Property Rights,TRIPS) 为主要法则,参与国际公共卫生事务的指导原则紧紧围绕非歧视原则、最惠国待遇原则和国民待遇原则3 项基本原则[9]。WTO 相比于WHO 而言,“市场原则”是其主导的规范和原则,更强调通过保护知识产权的方式来激励药品等医疗卫生产品的研发和制造。
2.3 FDA、EMA 等相关监管体系
美国食品药品监督管理局(FDA) 于2013 年发布《推动药品监管科学的战略和实施规划》(Strategy and Implementation Plan for Advancing Regulatory Science for Medical Products),提出药品监管科学的相关知识、方法、标准和工具,提高监管决策的确定性和一致性。2016 年12 月,美国公布《21 世纪治愈法案》(21st Century Cures Act)实施计划,对未来10 年医药领域的美国国立卫生研究院(NIH)、FDA、美国卫生及公共服务部(HHS)等组织给予医疗创新、疾病治疗和大健康发展的资助。2018 年1月,FDA 仿制药办公室(OGD)和药品质量办公室(OPQ) 发布《ANDA 提交质量管理规范》(Good ANDA Submission Practices)草案和《ANDA 评估质量管理规范》(Good ANDA Assessment Practices),旨在提高FDA 仿制药审评的效率和可预测性,减少延迟批准仿制药上市的法规和技术障碍。2019 年2 月,FDA 发布《连续制造的质量考量》(Quality Considerations for Continuous Manufacturing) 草案, 并于2019 年9 月和2021 年3 月分别发布《技术现代化行动计划》(Technology Modernization Action Plan,TMAP)和《数据现代化行动计划》(Data Modernization Action Plan,DMAP),提出“通过使用预测模型和适当的趋势应用( 如人工智能) 来支持整个FDA 的转型”。2020 年11 月,FDA 启动新药创新科学技术方法(ISTAND)试点计划。
2003 年以来,欧盟通过《创新药物计划》(Innovative Medicine Initiative,IMI) 利用利益相关团体的联合力量, 解决新药开发过程中的障碍问题。2020 年3 月,欧洲药品管理局(EMA)发布《监管科学2025 :战略思考》(Regulatory Science to 2025: Strategic Reflection), 提出监管科学药品全生命周期内为管理决策提供信息,包括生物医学和社会科学,旨在开发监管标准和工具。2020 年7 月,EMA 联合欧洲药品管理局总部(HMA)发布《2025 年欧盟药品监管网络战略》(European Medicines Agencies Network Strategy to 2025),旨在促进科学和技术创新的应用转化,确保患者及时获得安全、有效和质量可控的药物。2020 年12 月,《EMA 未来五年药品监管网络战略》(EMA Five-year Strategy for Medicines Regulatory Network) 确立监管网络,确保满足患者需求的药物供应保障[10]。《EMA 2025 年监管科学战略》(EMA Regulatory Science to 2025) 提到:细胞与基因疗法、药械组合产品、新的临床试验设计、真实世界数据、大数据及人工智能(AI)等领域的革命性进展,对监管机构提出了重大挑战。2021 年, 欧盟发布《GMP/GDP 和PMF 远程评估指南》(Guidance Related to GMP/GDP and PMF Distant Assessments),旨在推动新冠肺炎疫情流行期间成员国药品监管机构相继出台指南,以指导远程非现场开展评估和检查等。
3 GRP 的分类与原则分析
3.1 GRP 体系分类设置分析
我国GRP 体系分类设置包括市场监管环节、监管工作流程、风险管理理念和组织协调机制等方面。
其一,市场监管体系规范是由国家法律法规、市场监管部门规章、规范性文件和技术规范标准等组成,并与药品GRP 形成一种相互衔接关系。药品安全相关的研发、生产、流通和使用等环节全生命周期管理,在药品监管系统内呈现为闭环管理模式,是以产品监管为主线的审评审批,并采用与生产、流通合并的质量体系监管方式。市场监管体系的制度文件,更多的是针对市场主体监管和事中事后监管流程,以及所推行信用监管、大数据监管、网格化管理、“双随机一公开”、部门协调等监管方法和手段,与药品安全领域的“全程管控”全生命周期管理相比较,更具有操作性并付诸实施。
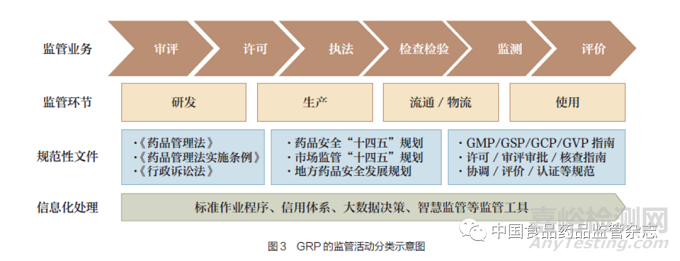
其二,传统的药品监管业务是从研发、生产、流通、使用等环节,包括《药物非临床研究质量管理规范》(GLP)、GCP、GMP、GSP 和GVP 等, 需要融合《关于进一步提高政府监管效能推动高质量发展的指导意见》所确立“建立全方位、多层次、立体化监管体系,实现事前事中事后全链条全领域监管”的理念。因而,根据药品监管内部工作流程,又可以分为审评审批、行政许可、监管执法、检查检验、不良反应监测、绩效评价等流程,与WHO 提出《医药产品监管质量管理规范》的临床试验监督、注册和上市许可、警戒、市场监督和控制、许可机构、监管检查和实验室检测的7 类监管活动相类似。
其三,基于风险管理理念的GRP 体系设置,主要体现在从我国药品不良反应监测报告制度的建立,到新修订《药品管理法》确立的“全程管控”“风险管理”和药物警戒制度。王丹等[11] 认为药物警戒就是一种药品风险管理;沈洁等[12] 建议构建药物警戒全生命周期管理体系。因而,基于风险管理理念的GRP 体系,是以药品信息追溯管理的药物警戒机制为特征,已成为药品监管业务流程制度设计的关键性要素。
其四,基于组织协调机制的GRP 体系设置,主要是我国药品监管部门积极争取利用和对标国际组织互认协议,推动国内药品监管体制机制改革和监管能力提升。ICMRA 指出,现有的国际监管协调、合作和信息共享机构包括ICH、PIC/S 和国家药品监管者计划(IPRP)等,监管机构可以通过制定通用程序、指南、要求和可互操作的基础设施来提高效率[13]。除国际组织互认协议之外,我国GRP 体系设置,还存在部际联席会议、区域一体化合作、药品监管与市场监管、药品监管与卫生医保、省级药品监管与市县市场监管等组织之间的协调机制等。
3.2 GRP 体系的建设原则
WHO 提出GRP 评估九大原则,要求国家监管体系具有合法性、公平性、一致性、均衡性、灵活性、有效性、高效性、清晰性和透明性。因此,GRP 建设路径设计不仅需要关注全球药品监管趋势,还要考虑我国城市治理体系和自身监管能力的发展程度。具体就建立和完善我国GRP 建设框架而言,应当遵循以下路径原则:①以药品监管现有相关法律,特别是《药品管理法》《疫苗管理法》《医疗器械监督管理条例》《化妆品监督管理条例》为基本依据。②借鉴国际最佳做法,包括发达国家和地区的药品监管体系。③基于目前各省市的监管体系发展水平现状和实施有效监管条件约束的考察。④基于国际组织和欧美对风险高低不同产品的认证、批准情况变化的考察。
具体来说,《药品管理法》《疫苗管理法》《行政许可法》《中医药法》等法律制度框架下的我国GRP 建设原则,包括以下几方面:①遵照WHO、ICH 和ISO 等国际组织的国际互认协议。②构建国际互认、部门协调、区域一体化和职权划分的协调层级。③地方性GRP 实践和制度创新行动。④市场监管和卫生健康部门管理活动的制度移植。⑤基于监管信息的电子化、数据化的工作流程再造。
3.3 GRP 建设维度和内容
根据药品全生命周期不同的理论和划分方式,结合药品监管业务特点、风险分级管理和监管实践经验,可将GRP 分为研发、生产、经营和使用等环节,以及审评、许可、执法、检查检验、监测和评价等监管业务;并需要从药品监管的上市许可、审评审批、检查、监测、检验和评价等维度设计和编制GRP,并覆盖研发、生产、经营、使用和物流等环节(图3)。同时,编制GRP监管体系内容时,必须考虑到监管主体在对全生命周期监管中所涉及的技术规范编写和管理时的GRP 体系。因此,根据WHO 发布的《医药产品监管质量管理规范》《医药产品监管互信质量管理规范》建设内容,我国GRP 的体系内容可包括但不限于[14] :确定组织的使命、愿景和职能;确保组织对政府、受监管对象和公众负责的机制;评估目标实现情况的可能性;确保结果对申请人、专家和公众透明的机制;承诺公平;出具使公众能够作出决定的论点;合理评估期限(不损害质量、安全和可靠性);加快审查罕见病药品和具有公共卫生价值的药品;上诉和投诉的规定;监管人员合格且有资格、有必要的设备;公平和透明的机制,诚信正直;具备人力资源发展计划;获得适当的知识和技术;向公众提供准确和适当的药品信息;确保质量的操作程序机制等GRP 体系内容。
4 GRP 的建设框架分析
4.1 GRP 建设框架的前提条件
GRP 建设框架的前提条件包括“四个最严”“营商环境”政策、约束条件、监管层级和市场监管工具等方面。
首先,我国药品监管工作践行国家确立的“四个最严”“营商环境”“放管服”等政策目标。深入贯彻落实习近平总书记关于食品药品安全“四个最严”要求(最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责);坚持科学化、法治化、国际化、现代化的药品监管工作发展道路[15]。2013 年,党的十八届三中全会明确提出“建设法治化营商环境”的目标。营商环境的优化体现了市场发展环境的公平、政策政务环境的高效以及科技创新环境的自由[16],良好的营商软环境会有助于促进经济发展[17]。2015 年5 月,国务院召开全国推进简政放权放管结合职能转变工作电视电话会议,首次提出“放管服”改革理念。
其次,GRP 构建的约束性条件,主要是指GRP 体系建设受部门协调机制、监管工具方法、人的现代化和基层监管实践等多种因素的制约。例如,美国FDA明确了《技术现代化行动计划》《数据现代化行动计划》提升药品监管能力。ICH 和PIC/S 发布数据可靠性的指南,以及对药品监管工作工具和方法探索和研判,是药品监管数字化转型和智慧监管行动计划落实的条件。
再次,国家、省级和基层监管层级方面,主要包括:国家药品监管部门负责标准管理、注册管理、质量管理、上市后风险管理等;省级药品监管部门负责药品生产和批发经营企业的行政许可和管理工作:市县市场监管部门负责药品零售和使用的管理工作等。
最后,药品市场监管工具/技术,主要包括风险管理、全生命周期管理、追溯管理、上市后管理等制度,以全产业链、全过程的监管理念为基础。全生命周期管理需要以信息化和数字化手段为支撑条件,并以药品监管的规范化和标准化流程再造为基础,需要开发GRP 为基础的市场监管工具,通过将标准化和监管规则转化为工作流程,有效推动药品监管方式转变。
4.2 GRP 建设框架制度设计的相关要素
作为行政管理领域的GRP,其建设框架设计可借鉴钱学森院士提出的“三个层次一座桥梁”系统科学的体系结构②,分为四层级:监管伦理、协调机制(基层科学)、系统化体系规范(技术规范)、科学监管规范(工程技术),并将大数据决策体系合并于系统化体系规范,构建指导药品监管工作的体系规范。
首先,药品监管的协调机制,包括国际组织、政府部门、区域一体化、省级药品监管市场监管4 个层级,以及药品监管系统内部协调机制等。国家药品监管部门与WHO、ICH、PIC/S 等国际互认关系;围绕京津冀、粤港澳大湾区、长江三角洲、成渝地区双城经济圈等区域监管一体化体系,进行药品监管的跨省检查、联合检查和检查互认等的区域协调机制;市场监管和药品监管协同机制,体现在各级市场监管与药品监管之间在信息报送、稽查执法、检查检验、监测评价、人员调派、教育培训、应急处置等各方面的工作机制。
其次,药品监管工作规范主要是指国家或地方药品监管部门编制和发布的多项药品监管体系规范。调研中发现,这些药品监管规范性文件仍呈现出碎片化、缺乏系统性等特点,需要对其进行系统化、公式化的知识管理,以形成系统化的监管体系规范。
再次,近些年美国FDA 和欧盟药品GMP 检查中发现数据造假的案例越来越多,数据完整性和可靠性已成为全球卫生机构与制药行业所关注的重点。很多国外药品监管当局在其执法行动中的警告信、进口警报、产品扣留,以及暂时取消或撤销上市许可中都非常关注数据完整性问题。
最后,国家药品监管部门启动的药品监管科学行动计划,将项目研究设定在细胞基因治疗、药械组合等前沿性和交叉性技术等方面,依据钱学森院士“三个层次一座桥梁”体系结构中的工程技术层级知识体系比对来看,其仍属于科学监管工具范畴,不足以支撑我国GRP 建设的制度设计。
4.3 GRP 体系构建框架的制度设计
当前,我国在推进GRP 建设进程中,一方面是积极参与国际组织并对标国际和制度移植,另一方面需要与监管责任考评相结合,借鉴市场监管和卫生健康部门的实践经验和地方性GRP制度创新活动, 以创建良好的GRP 体系建设的制度环境(表3)。GRP 建设的框架设计中,药物警戒制度涉及全生命周期管理的理念。例如,国际医学科学组织理事会(CIOMS) 和ICH 对药物警戒的法规体系、技术标准的建立发挥了重要作用。目前,ICH 的药品注册技术要求四大指导原则包括质量模块(quality)、安全性模块(safety)、有效性模块(efficacy)、多科学性模块(multidisciplinary),已成为当前我国药品监管制度移植的主要制度集合。
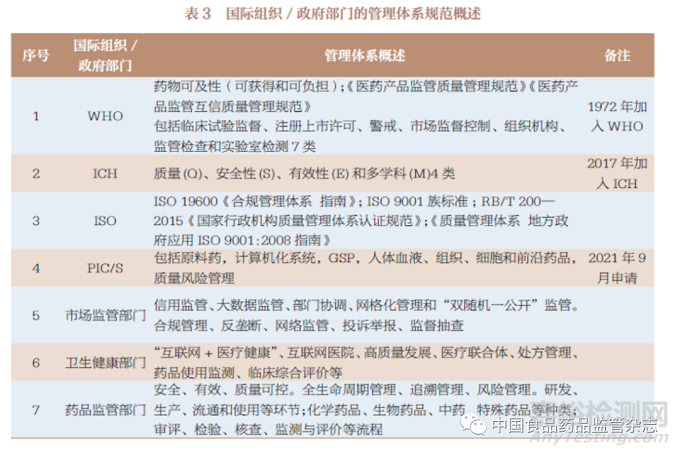
我国药品监管部门在GRP建设框架的制度设计时,诸如部门规范性文件的制修订,首先必须严格符合《立法法》《重大行政决策程序暂行条例》《国务院办公厅关于全面推行行政规范性文件合法性审核机制的指导意见》《国务院办公厅关于加强行政规范性文件制定和监督管理工作的通知》等;其次是遵循国际互认协议(ICH、PIC/S、IPRP)、区域一体化规划、部际联席会议制度、市场监管(信用、大数据、网格化、“双随机一公开”)等。在GRP 建设原则、框架设计之后,再进行GRP 制度遴选的多目标决策研判;采用霍尔三维空间结构系统分析框架,提出基于逻辑维(组织协调)、时间维( 工作流程)、知识维(专业知识)的GRP 建设框架制度(图4);药品监管的技术科学方面, 可从国际组织互认协议(WHO、ICH、PIC/S、ISO)和欧美国家或地区药品监管体系规范(指南/ 标准)实践中进行制度移植。

4.4 GRP 规范/ 指南编制的变量选择
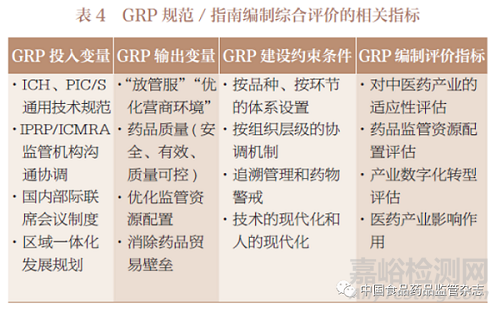
我国药品监管部门所采用国际互认协议(WHO、ICH、PIC/S)及借鉴国外政府的指南/ 标准,其背后逻辑是发起国的制度背景,即欧美日的药品监管体系规范和技术性贸易壁垒。我国药品监管部门发布GRP 规范/ 指南时,不仅考虑产业高质量发展和国际互认协议,更需要基于监管体制机制和基本国情,同时也要转变当前规范性文件和指南编制发布的过密过快工作方式。我国GRP 建设是多目标决策体系,包括GRP投入变量、输出变量和约束条件,以及决策考核机制(表4),基于指标获取和分析,实行我国GRP框架制度设置效果的综合评价。
5 结语
GRP 体系建设,具有增进药品监管国际合作、降低技术性贸易壁垒、为机构改革职能转变提供决策参考,以及对提升我国药品监管体系现代化进程有重要意义。WHO 确立的GRP 体系建设是保障公众健康服务体系的必要组成部分,将公众的健康和合法权益委托给具有良好GRP 的监管机构至关重要。基于国内的GRP 研究成果和地方实践仍处于萌芽阶段的现况,需要从GRP建设的总体目标、原则、框架、流程和标准等方面,采用制度移植和系统评价方法,尽快建立适合我国国情的数字化转型、高质量发展和监管资源优化等的GRP体系框架,保障药品监管行为依法、规范、有效。
①“麻醉药品管制模式的实践”来自《麻醉药品和第一类精神药品价格机制研究》报告(内部资料)。
②三个层次一座桥梁:工程技术、技术科学、基础科学三个层次,和用系统论的“桥梁”连接到哲学层次。

来源:中国食品药品监管杂志


