您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-20 01:15
在体外构建组织模型或器官的过程中加入血管系统对于输送营养物质、氧气和移除代谢废物,从而提高体外构建组织的存活率及组织厚度是非常必要的。近年来,基于对血管组织结构及组织微环境的深入了解,利用水凝胶材料构建高度复杂仿生的血管化组织和器官取得了巨大的进展。在这篇综述中,作者强调了利用水凝胶材料体外构建血管化组织的独特优势。首先,作者简要介绍了血管的组织结构、微环境及血管形成、血管出芽的机制。然后,重点介绍了水凝胶作为仿生细胞外基质(ECM)在构建血管化组织或器官中的重要性和优势,包括可调节的物理特性、生理环境的高度相似性以及可控的凝胶化过程。此外,作者讨论了基于水凝胶的血管化组织在组织再生、药物筛选及器官芯片中的应用研究。最后,作者提出了水凝胶材料利用及血管化组织构建过程当中需要解决的关键问题,包括水凝胶的多功能性、合适的细胞表型的选择、复杂的工程技术以及如何将复杂的血管化微组织推向临床转化,以促进其未来发展。
01、研究内容简介
组织工程旨在体外或体内进行组织或器官构建,为克服因疾病、创伤和人口老龄化引起的器官短缺带来的挑战提供了有效的方法。可将利用工程组织方法得到的体外组织模型或器官用于临床移植、疾病模型的构建及药物筛选。然而,目前的研究表明,由于体外构建组织/器官过程中无法系统地复制体内器官组成和细胞微环境,因此制造多功能的复杂组织或器官仍极具挑战性。
组织和器官的存活及形成依赖于有效的血管网路实现营养物质的运输、代谢产物的移除以及氧气的输送。在体外构建组织/器官过程中,如何将复杂的血管网络加入到体外组织/器官模型中,已成为限制使用各种微加工方法制造仿生组织或器官的主要障碍。此外,体外构建的组织中有限的血管网络往往导致物质运输范围的局限性(距离供应脉管系统在100-200 μm范围内),导致体外培养的细胞不能在短时间产生足够多的ECM、细胞存活困难体外构建的组织厚度难以增加等问题。因此,血管化问题是组织工程技术发展所必须解决的一个挑战性问题。
除了有效的血管网络之外,完全模拟组织/器官的生理微环境仍极具挑战性。由于体内组织中真实的微环境过于复杂,体内组织/器官多种细胞类型的精确空间分布、ECM的动态调控过程、以及ECM中细胞的复杂相互作用机制,需要进行更深入的研究。简单来说,ECM是一种由多糖和蛋白质组成的网状结构,可根据类器官形成和组织再生过程阶段的生理需求,进行细胞行为和器官功能的调控。综上,有效的血管网络和复杂的ECM是血管化组织工程策略必不可少的关键因素。
在基于天然材料和合成材料的多种生物材料中,水凝胶材料由于具有高渗透性、高含水量及优异的生物相容性,被认为是包埋细胞、负载细胞因子及传递药物的有效载体。除此之外,由于水凝胶材料的机械强度适宜且高度可控,更适用于人体大多数软组织的体外构建。因此,水凝胶材料的发展为体外构建血管类似物及血管化微组织提供了可能。1960年,Wichterle和Lim将聚(甲基丙烯酸-2-羟乙酯)基材料交联后用作软性隐形眼镜,首次报道了水凝胶在人体组织中的应用。随后,在1980年,水凝胶首次被用于包埋细胞。
具体而言,水凝胶由亲水性聚合物链组成,这使得多种细胞、药物、细胞因子能够在水凝胶中均匀包埋,以实现组织的复杂性模拟。此外,水凝胶网络中的分子可以通过相互连接的孔隙扩散,这满足了血管系统将分子从血管输送到组织的需求。如今,水凝胶已经被广泛的研究并应用于临床治疗当中。迄今为止,许多研究人员已经报道了使用各种新兴的生物制造技术,基于水凝胶建立了尺寸从微米到毫米的中空血管结构。此外,血管生成相关因子可以直接加入到水凝胶网络中,以调节生物信号的传递并加速构建组织模型中的血管形成。最重要的是,这些基于水凝胶的可灌注组织模型在体外探索器官的病理形成和生理活动机制方面显示出巨大的潜力。
在这篇综述中,作者首先介绍了两种主要的血管形成机制,包括血管形成和血管出芽。此外,重点介绍了水凝胶作为仿生ECM在构建血管化组织或器官中的重要性和优势,包括可调节的物理特性、生理环境的高度相似性以及可控的凝胶化过程。最后,讨论了基于水凝胶的血管化组织在组织再生、药物筛选及器官芯片中的应用研究。同时,作者提出了水凝胶材料利用及血管化组织构建过程当中需要解决的关键问题,包括水凝胶的多功能性、合适的细胞表型的选择、复杂的工程技术以及如何将复杂的血管化微组织推向临床转化,以促进其未来发展(图1)。
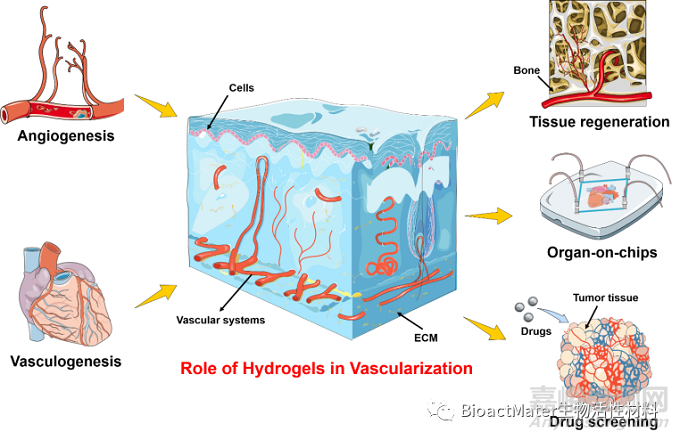
Fig. 1. Schematic illustration of the vascularized tissues in hydrogels for tissue regeneration, organ-on-chips, and drug screening. Angiogenesis and vasculogenesis mechanisms of vascular formation are introduced both in the embryo stage and postnatal life, respectively. The enrichment of the effective vascular networks enables the delivery of nutrients and waste products for the recovery of organs upon severe damage. In addition, the emerging organ-on-chips approach provides excellent opportunities for incorporating vasculatures within chips for the stimulation of physiological 3D organoids. These target 3D organoids bridge the gap between clinical trials and in vitro drug screening.
血管系统是全身循环系统的重要组成部分,分布在整个人体中,其分支血管的直径从几微米到几毫米不等(图2)。人体血管由动脉,静脉和毛细血管组成。动脉的主要功能是从心脏开始,血液流向身体器官、组织和肺组织;静脉的作用是将血液从身体组织或肺部带回心脏;毛细血管的作用是连接动脉和静脉,在毛细血管的组织和血管之间交换氧气、二氧化碳和营养物质。不同位置及功能的血管在物理特性(包括厚度、几何形状、壁成分和机械强度)和生理环境(包括GF、ECM成分和特定细胞类型)方面的异质性,为利用生物制造技术体外构建血管及血管化微组织提供了设计标准。
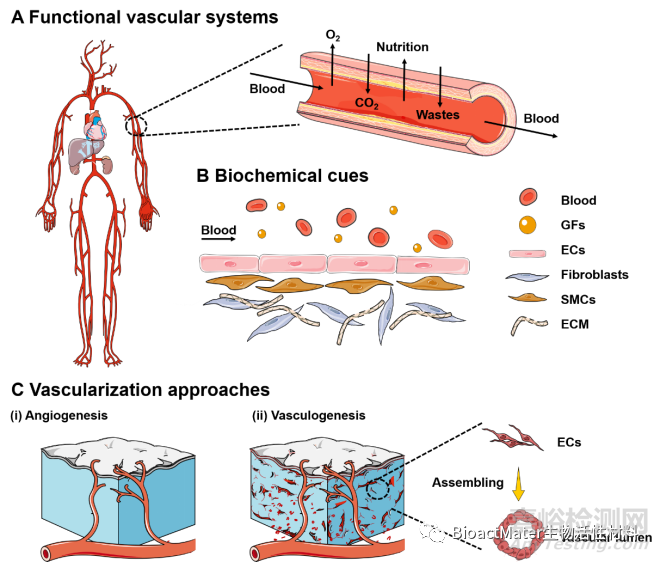
Fig. 2. (A) Schematic representation of functional vascular distribution in the human body. The vascular networks are organized into arteries (in red) and veins (in blue). The vasculatures comprise blood-carrying lumens. (B) The biochemical cues, including relevant cells and specific GFs, are expected to be integrated within the designed vascularized tissue constructs. (C) Vascularization mechanisms during (i) angiogenesis and (ii) vasculogenesis. Angiogenesis mainly relies on the sprouting of ECs to the fabricated constructs. Vasculogenesis primarily focuses on the differentiation and assembly of angioblasts and endothelial precursor cells (EPCs) into mature migrating ECs towards the repair region and subsequently forming the primitive vascular networks. (For interpretation of the references to color in this figure legend, the reader is referred to the Web version of this article.)
各种研究表明,多种细胞因子及生物分子在组织工程支架中的协同作用可以调控血管网络的形成进程,并有效地提高体外血管化组织的可行性。在此过程中,水凝胶已被广泛研究作为各种疏水或亲水分子的载体,通过可控释放将这些生物信号分子传递到目标部位或受损组织,并调控血管生成及组织再生过程(图3)。
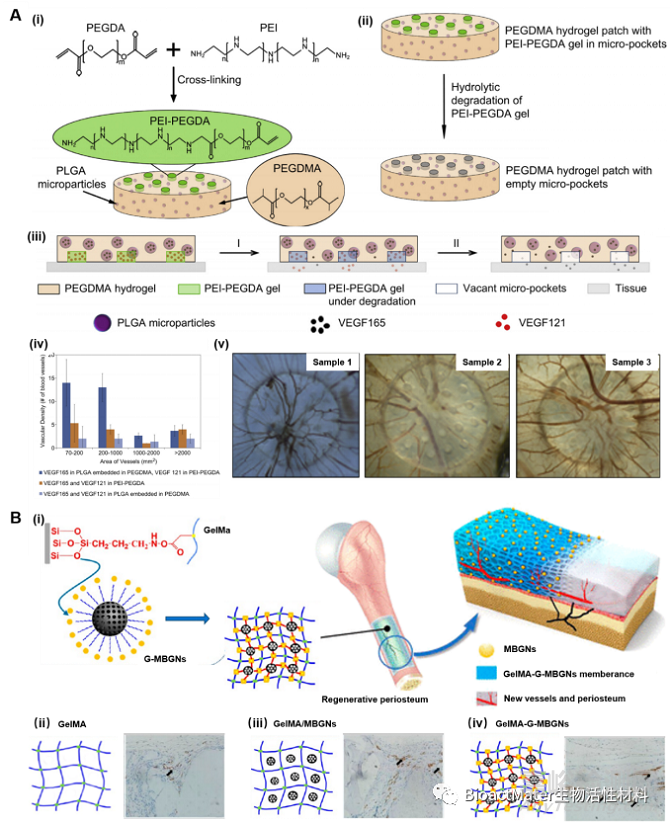
Fig. 3. The design and application of (A) nanocomposite hydrogels and (B) micro composite hydrogels for angiogenesis and vasculogenesis.
水凝胶亲水聚合物链交联的形成水凝胶的方法很多,通常可根据材料的化学性质、预期的功能及所使用的生物制造技术来选择,一般可以分为物理交联和化学交联法。温和的交联过程有利于细胞的包埋及药物的封装(图4)。
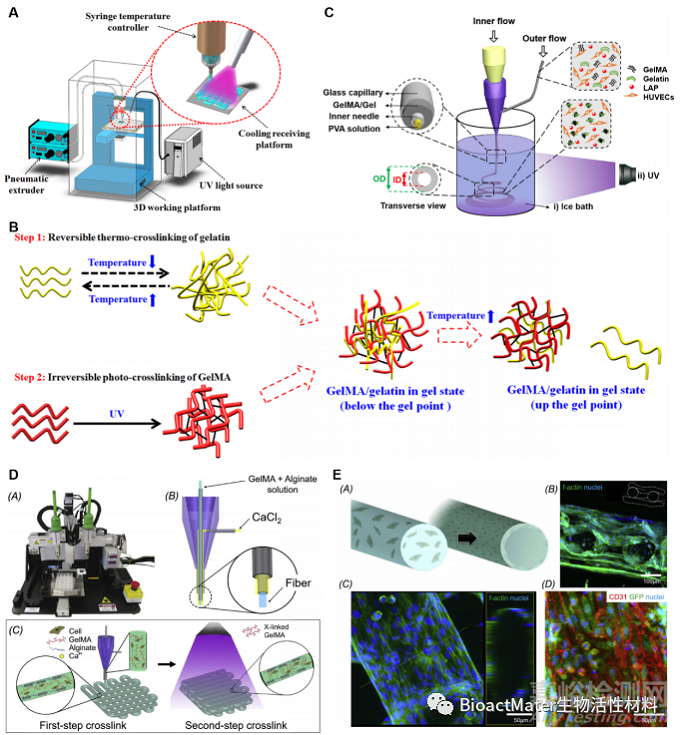
Fig. 4. (A) Schematic of the 3D bioprinting system: the cooling system under the receiving platform temporarily thermo-cross-linked gelatin in the bioinks; and the UV light permanently photo-crosslinked GelMA in the bioinks. (B) Two step cross-linking of GelMA/gelatin bioinks. (C) Schematic illustrating the setup for generating hollow GelMA/Gel microfibers by microfluidic coaxial biofabrication for cannular tissue engineering. (D, E) Photograph of an Organovo bioprinter. Schematic of the coaxial needle where the bioink is delivered from the core and the ionic crosslinking CaCl2 solution is sheathed on the side.
迄今为止,大量的研究已经证明了水凝胶可以模拟各种器官类型,包括但不限于骨骼、肾脏、肝脏、肺、肌肉和脑。这些精准、可重复的3D类器官的构建为展开组织再生、器官芯片和药物筛选提供了可能(图5)。
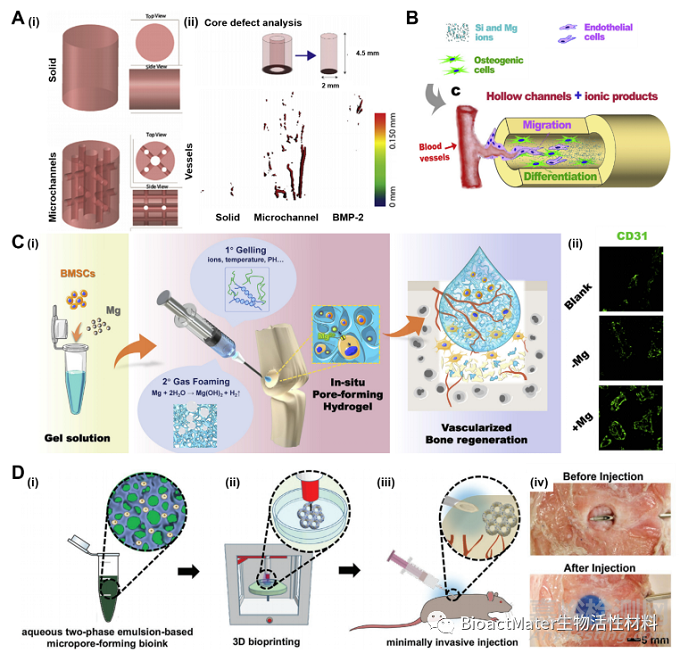
Fig. 5. (A) (i) Outline of construct design (solid and microchanneled), top and side views demonstrating interconnected microchannel network within the constructs. (B) Schematic drawing representing the printing process of the hollow-strut-packed. (C) Schematic illustration of vascularized bone regeneration and expression of endothelial marker CD31. (D) Schematic showing the fabrication process of the 3D-bioprinted hierarchically porous hydrogel constructs by using an aqueous two-phase bioink.
由于微流体技术的突破,新兴的器官芯片方法为构建3D器官模型提供了可能。此外,在微流控芯片中嵌入水凝胶在构建多样化的仿生组织模型方面已取得巨大进展,包括模拟组织结构异质性、细胞空间分布、组织尺寸和ECM组成。另外,通过使用水凝胶芯片制造血管网络、实现组织-组织界面的模拟及构建3D类器官已经取得了显著性突破(图6)。
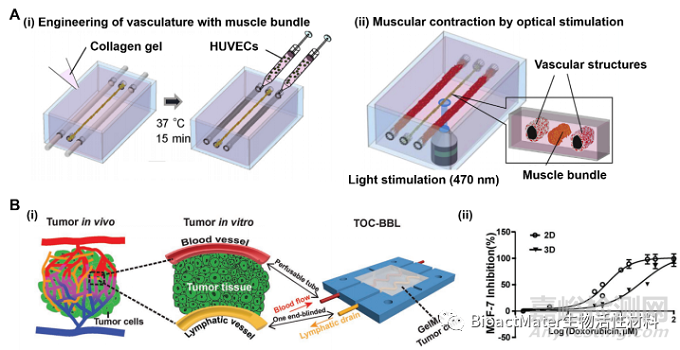
Fig. 6. (A) Schematic showing fabrication of the endothelial vessels with the muscle bundle. Reprinted with permission from Ref. [188]. Copyright 201, Elsevier Ltd. (B) (i) Schematic of the bioprinted blood and lymphatic vessel pair containing the pair of bioprinted blood/lymphatic vessel. The red-colored perfusable hollow tube was bioprinted to provide blood fluid flow, the yellow-colored one end–blinded hollow tube was bioprinted to enable lymphatic drain flow, and the chamber was seeded with tumor cells embedded in an extracellular matrix (ECM)-like a hydrogel. (ii) Dose-response curves of 2D- and 3D-cultured MCF-7 cells to DOX. Reprinted with permission from Ref. [51]. Copyright 2019, Wiley. (For interpretation of the references to color in this figure legend, the reader is referred to the Web version of this article.)

来源:BioactMater生物活性材料


