您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-18 07:23
分析方法转移就是记录一个实验室(接收方)能够使用由另一个实验室(转移方)所开发检验方法的过程,确保接收实验室熟悉检验程序并有能力进行检验。其实质是通过分析方法转移方案,确认接收实验室有能力形成方法并获得与转移实验室相同的准确度和精密度。
方法转移包括一系列步骤,从计划开始,到报告结束,其步骤如下:
1、转移计划
分析方法转移可能发生在研发过程中的任何阶段,比如工艺放大、注册批生产、批准后生产工艺变更。产品研发的一个重要里程碑是将注册批次的生产工艺和检验方法转移到拟定的商业生产地址,因此应完善生产工艺和检验方法,使拟定商业生产地址能够获得生产工艺和检验方法的经验。
在方法转移前,应成立转移小组,成员包括双方经理、QC和QA。小组章程、组成和时间安排应相互沟通并记录在分析方法转移计划中。
2、方法转移包
转移实验室提供信息包作为分析方法转移的第一步。在分析方法转移包中协商并记录拟转移的方法、时间点和转移方式(验证、对比试验、共同验证);提供方法的所有知识文件,主要包括分析操作规程、质量标准、验证报告(符合法规要求)、有代表性的数据(如典型色谱图)、分析方法开发报告、风险评估以及耐用性试验结果;另外还应详细描述影响分析方法转移的关键因素如实验室环境、样品前处理、仪器设备等。
3、仪器设备
应对转移方和接收方的仪器设备进行评估。供应商和仪器型号的差异可能会对分析方法的性能产生重大影响。转移方使用的仪器配置应与接收方进行沟通,方法中使用的任何一个附加设备都应详细说明。
4、检测用样品
选择的样品应具有代表性,如过期、老化、加标的样品可能不具有代表性。应评估所选样品异常结果对临床供应的潜在影响。通常不建议对多个样品批次进行检测,因为在评估中会增加样品方差作为一个因素,从而混淆了评估结果。
5、接受标准
理想情况下,接受标准应与方法验证报告一致,然而一般情况下标准设置的比较宽,从而容易达到要求。通常以验证结果和转移前可行性研究作为指导,制定合适的、有意义的接受标准。
6、熟悉方法
在分析方法转移前,应进行实验室实验(即可行性研究),这些可行性研究应足够深入(可发现导致方法转移失败的问题),使接收方能顺利地完成方法转移。可行性研究不作为正式研究的一部分,在预试验中产生不可接受的实验结果需在转移之前采取措施,比如进行培训、方法评估、修改方案等。
7、转移方案
转移方案应详细地描述分析方法、所用的试剂、仪器设备、样品批次、对照品信息、待评估的方法参数以及可接受标准等。转移方案由转移方或接收方起草,双方负责审核批准。
8、转移报告
方法转移的最后一步是完成转移报告。一般来说,转移方完成转移报告的编写,双方根据事先商定的格式提供结果(双方数据均应进行同行评审),并与接受标准对比,以完成方法转移。
分析方法转移的方式如下:
A、对比试验 对比试验是让转移方和接收方在合理的、较短时间内完成一批样品的检测,然后根据方案中规定的接受标准对每个实验室的结果进行比较和评估。某些情况下,可以将接收方数据与转移方生产的COA进行比对,前提是COA是在与接收实验室生成的数据相关的合理时间内生成的。
B、共验证 大多数情况下,转移方实验室对于方法的验证优先于接收方实验室,因此,共同验证不是一个好选择。但是,分析方法从公司的研发部门转移到QC实验室,采用这种方式是一个好的选择。该方式的缺点是接收方结果不符合接受标准,将导致方法转移失败,避免这一潜在问题的关键是记录中间精密度试验,使得转移实验室能够继续生成可报告的数据。
C、完全验证 接收方对方法进行全验证是一种常用方法,这种方法虽然耗费时间和资源,但提供最高水平的保证,即接收实验室可用该方法产生可接受的结果。这种方式常用于早期阶段,或用于纠正或完成之前未按照法规要求执行的验证元素。
D、转移豁免 采用这种方式要记录并说明原因,如接收实验室检验过类似样品,并对检验步骤熟悉;熟悉该方法的分析员调到接收实验室等。
在分析方法转移前,还应进行风险评估,确定可能影响的因素,并对风险进行评级,确定消除风险的方法。以HPLC为例:
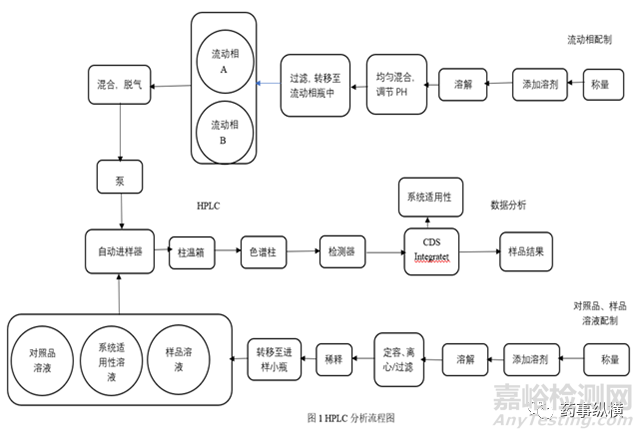
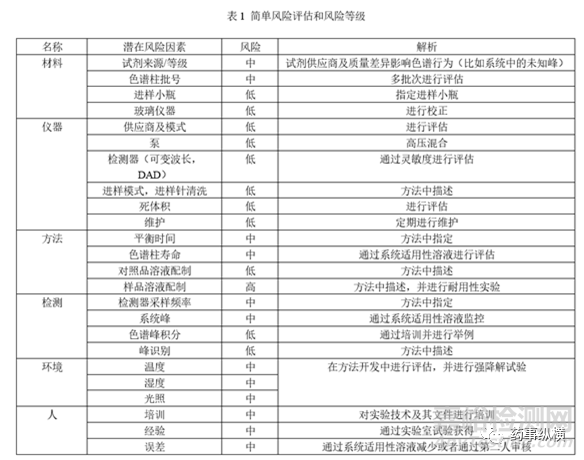
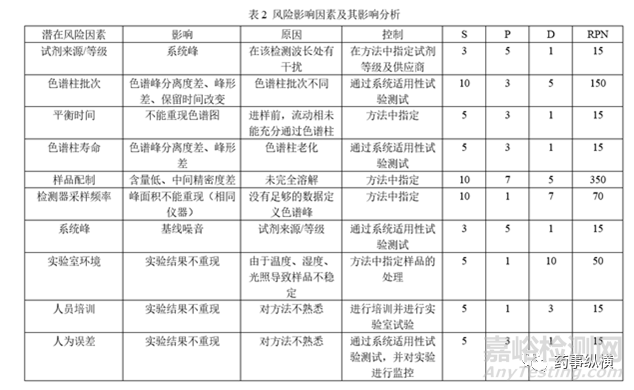
方法转移中难免遇到许多问题,需要明确检验方法、关键风险因素、进行可行性研究及现场培训,双方及时沟通,解决问题,顺利完成方法转移。

来源:Internet


