您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-23 08:12
摘 要 / Abstract
为保障人民用药安全有效、使用方便,国家实行处方药与非处方药分类管理。非处方药品的各种属性均应体现“适于自我药疗”,而评价药物是否适于患者自我药疗的研究尚未在国内普及,国内也无相关指南或指导原则指导企业开展相关研究。本文介绍了美国FDA关于非处方药自主选择研究的行业指导原则,供国内非处方药企业参考。
In order to ensure the safety,effectiveness and convenience of drug use,China implements the classification of prescription drugs and nonprescription drugs.All attributes of nonprescription drugs should reflect “appropriateness for self-medication”,but studies evaluating whether they are "appropriate for self-medication" has not been popularized in China,and there are no relevant guidelines or directions for industry to carry out relevant research.This paper introduces U.S.FDA’s guidance on self-selection studies for nonprescription drug products,which can be used as a reference for studies on nonprescription drugs in China.
关 键 词 / Key words
非处方药;自主选择;FDA ;指导原则;自主选择研究
nonprescription drug products; self-selection; FDA; guidance; self-selection study
为保障人民用药安全有效、使用方便,国家实行处方药与非处方药分类管理。非处方药不需要凭执业医师或执业助理医师处方即可自行判断、购买和使用[1]。在申请转换为非处方药时,药品的各种属性均应体现“适于自我药疗”,这同时也是审评人员审评的关键点。消费者进行自我诊断、自我药疗情况下的药品安全性评价主要从以下两个方面的研究进行评价,一是消费者能否自我判断药品的适应症,二是消费者能否自我用药[2]。目前,以上相关研究尚未在国内普及,国内也无相关指南或指导原则指导企业开展相关研究。美国FDA于2013年出台了《非处方药自主选择研究行业指导原则》[3],涵盖了自主选择研究中研究设计、方法学研究和分析的一般原则,为行业开展自主选择研究提供建议。本文旨在介绍该指导原则的主要内容,为我国非处方药企业开展自主选择研究提供参考。
01 背 景
某些非处方药产品的研发过程除了要开展必要的安全性和有效性研究外,还可能包括消费者研究。消费者研究包括标签理解研究和自主选择研究。标签理解研究评估消费者是否理解标签中的主要信息,自主选择研究测试消费者是否能将其个人健康状况与标签信息相对应,以正确决定自己是否适合使用该药品(自主选择决定)。FDA建议在开展自主选择研究之前,先开展标签理解研究来优化标签信息。
为测试消费者能否根据标签中包含的信息作出正确的自主选择决定,需要开展自主选择研究。FDA建议在以下情况下考虑开展自主选择研究:
药品含有新的非处方适应症。
药品涉及新的非处方目标人群。
有特定人群不应使用指定的非处方药品(如糖尿病患者、移植接受者)。
对批准的非处方药产品标签信息有重大更改的,且该更改可能会影响非处方药适用人群(如对警告、使用说明的修改)。
FDA鼓励申办者就自主研究方案向其征求意见和建议。
自主选择的结果并不一定能预测消费者是否真的会使用该药品或能否正确使用该药品。如果需要有关消费者使用的信息,应考虑开展实际使用研究。实际使用研究不在自主选择研究指导原则范围内。
02 研究的设计与开展
一般来说,自主选择研究可以是开放标签、无对照研究。以下是针对设计和开展自主选择研究的一般建议。后续章节将对每项建议进行更详细的讨论。
陈述研究的目的和目标。
针对研究目标细化研究设计,并计算合适的样本量。
使用与最终药品标签尽可能相似的标签。
针对研究目标设计一份问卷。
尽量减少可能导致偏倚的因素(例如,具有倾向性的抽样、招募策略、引导性问题和访谈)。
根据研究目标招募适合的人群。
招募识字水平较低和正常的受试者。
必要时,通过招募有部分或全部禁忌症的受试者来丰富研究。
在开展大规模的自主选择研究之前,开展试点测试。
自主选择可以通过多种方法来研究,有时可以作为实际使用研究的一部分进行评估,有时也可以结合标签理解研究进行评估。因此,评估自主选择不一定要开展单独的研究。
2.1 研究目标
2.1.1 首要目标
一般来说,自主选择研究的首要目标应该是评估受试者在阅读药品标签后,能否结合自身的健康状况作出正确的自主选择决定。
2.1.2 次要目标
次要目标可包括评估特定目标亚群的自主选择准确性和(或)评估受试者作出错误自主选择决定的原因。因此,一些数据可能来自为了获知自主选择错误的原因而询问的问题。确定为什么受试者会作出错误的决定是十分重要的,这有利于更好地掌握需要修改哪些标签信息,从而帮助患者作出正确的自主选择。
2.2 研究人群
应根据研究目标确定研究人群。一些研究可能包括任何想要使用该药品的受试者,无论其年龄、性别、潜在的健康状况以及是否使用合并药物;另一些研究可能针对特定人群(例如,患有特定疾病的受试者,这些受试者可能为该药的禁忌人群)。由于非处方药产品可在没有医务人员指导的情况下购买,且研究中无需服用药品,因此排除标准应为最低限度(例如,无法说、读或理解英语)。
自主选择研究还应该招募足够数量的识字水平较低的受试者,以检验该亚组作出正确的自主选择决定的能力。教育水平不能替代识字测试。在筛选时,申办者应通过使用经验证的工具来评估研究对象的识字水平,如成人医学识字快速评估(REALM)测试,用于测试青少年的REALM青少年版,以及成人功能性健康识字测试(TOFHLA或S-TOFHLA)。研究人员应接受一定的识字测试培训。
2.3 统计考量和数据分析
2.3.1 主要终点、成功标准和缓解因素
自主选择研究的主要终点应该是作出正确自主选择决定的受试者的比例。正确的自主选择决定是基于一定的标签信息,这些标签信息对于受试者作出是否使用药品的决定(自主选择决定)是必需的。正确的自主选择决定可以基于单个标签信息,也可以基于多个标签信息。
例如,某种药品可能只有一个禁忌症:糖尿病患者禁止使用。在这种情况下,对于糖尿病患者而言,正确的自主选择决定(无论其是否有该药品标明的适应症症状)是该药品不适合其使用;反之,不正确的自主选择决定即是一名糖尿病患者选择使用该药品。多个标签信息组合的一个例子是,对于一种仅适用于18~65岁之间且无心脏病或高血压的女性的药品,正确的自主选择决定应该是一名年龄在18~65岁之间的女性,她有说明书中标明的适应症并且没有心脏疾病或高血压,选择使用该药品;而错误的自主选择决定可能是一名55岁、患有高血压的女性选择使用该药品(无论她是否有说明书标明的适应症症状)。
有几种可用于说明自主选择决策的分析方法,通常选择一至两个作为主要终点,其他可用于探索性分析。表1显示了一种选择不同终点的方法,其中A、B、C、D表示单元格中的受试者数量。
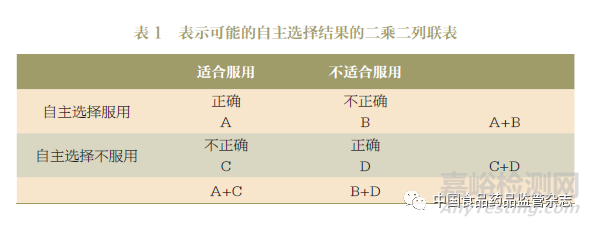
对主要终点分析方法的选择取决于研究设计和非处方药使用中最关注的问题。例如,主要终点可以是整个受试人群中作出正确自主选择的比例[(A+D)/(A+B+C+D)];或者是在选择服用药品的受试人群中作出正确选择的比例([A/(A+B)]。再如,主要终点可以是那些不适合服用药物的人作出正确自主选择的比例[D/(B+D)]。主要终点及其计算方法应在研究开始前的方案中确定,并与FDA讨论。
成功标准应与预先设定的正确自主选择的目标水平相关。这个目标水平应该基于临床合理性设定。成功标准应使用置信区间:只有当预先设定正确自主选择率值的双侧95%(或单侧97.5%)置信区间的下限高于目标水平时,研究才能被视为成功。建议使用双侧95%置信区间来估计正确的自主选择率以及确定成功标准。这种方法允许考虑研究数据的变异性,并将单侧试验的I型错误率(2.5%)设置为双侧试验中使用的常规I型错误率(5%)的一半。
在某些情况下,可以接受合理的预先设定的缓解因素。缓解因素是受试者的反映,可以使看似不正确的自主选择决定被视为正确的自主选择决定。缓解因素应具有临床合理性。下面是一个缓解因素的例子:以年龄判断,受试者作出了错误的自主选择决定,但其与说明书适用年龄范围的差距在1年以内,并且口头表达了对正确年龄的理解。例如,某种药品说明书显示限55岁及以上的成年人服用,一名54岁的受试者根据年龄作出了错误的自主选择决定。为了获得更多关于其决定的信息,受试者被要求回答一个非引导性的开放式问题,这时受试者表示自己知道药品的标签显示该药的用药人群为55岁或以上的人,但因为自己还差1个月即满55岁,因此觉得可以使用该药品。
对正确的自主选择决定、缓解因素和正确自主选择的目标成功标准的定义均应在研究招募之前确定,并在研究方案中明确说明。缓解决策应该是可审计的,并且应该提供受试者水平数据,以便FDA能够检查和审计缓解因素。如果申办者在事后分析中发现非预期的缓解因素,研究报告中应解释为什么以及如何使用这些因素来缓解终点。
对于更复杂的标签,例如具有多个决策点的标签,其中某些信息比其他标签信息具有更大的临床意义。因此,建议申办者在开展研究之前与FDA讨论用于确定正确自主选择、缓解因素和预设成功标准的标签信息。
2.3.2 样本量考量
自主选择研究中的受试者数量应足够大,以便为首要目标提供可靠的答案。研究样本量的确定应该基于假设检验框架中的成功标准。这通常涉及几个要素,包括正确自主选择的预先设定目标水平、研究人群正确自主选择的假定百分比、I型错误率,以及对检验预定的假设预期的研究效力。
样本量计算中每个不同元素的确定取决于以下几个方面:
如前面所述,正确自主选择的预设目标水平应具有临床合理性,与错误自主选择有显著性差异。
预设的正确自主选择百分比应与目标人群中真实的自主选择率尽可能接近。理想情况下,它应该基于对同一药品的试点研究结果确定,或基于类似药品在相似人群中的自主选择研究结果确定。
I型错误率应设置为2.5%(97.5%置信区间的单侧检验)或5%(95%置信区间的双侧检验)。
研究效力通常应由申办者基于自身的资源确定。建议研究效力达到80%或以上。
自主选择研究中的受试者数量应足够大,以评估重要亚组的主要终点。也可以为评估特定的亚组而开展有针对性的自主选择研究。
2.3.3 数据分析
研究方案中应明确定义计划使用的分析方法的主要特征。方案中还应说明统计方法、主要终点和次要终点分析;描述构造一个双侧95%置信区间来估计和确定正确自主选择率的成功标准的方法,包括对分子和分母的详细描述;并详细说明如何处理丢失数据。
通常,方案中应包括一个全面的统计分析计划及数据分析的所有细节。如果全面统计分析计划是一个单独的文件,应在知晓研究结果前准备好并提交FDA审查。
2.4 问卷设计
通常,自主选择研究通过问卷收集数据。问卷应符合两点要求:一是反映研究目标;二是优化所收集信息的真实性和可解读性。措辞、问题结构和问题顺序对所收集数据的真实性和可解读性有重要影响。在设计问卷时,以下几点值得特别关注。
2.4.1 强调研究目标的问题
对于强调研究目标的问题类型有下列一般性建议。
自主选择问题:第一个问题应该是一个开放式的自主选择问题(例如,“你使用这种药物可以吗?”),再跟进一个开放式、无引导的试探性问题。获知受试者作出错误决定的原因是十分重要的,这可以帮助了解需要修订哪些标签信息来促进正确的自主选择。
开放式、试探性问题:在自主选择问题之后应跟进开放式问题,有助于为分析提供额外数据。用于获取更多信息的额外问题应该是非引导性的,并且应谨慎使用,以免提示受试者说出想要的答案。对于回答“可以使用药物”的受试者,一个非引导性问题的例子是问他们“为什么这么说?”这个问题能够产生多种可能的回答,包括“我向医生咨询过”。反之,如果正确的回答是——受试者在使用药物前应该向自己的医生咨询,那么一个具有引导性的问题可以是“在开始使用药物之前,你会做什么吗?”这个问题可能会引导受试者给出正确的回答。此外,那些感到不得不提供答案的受试者可能会回答“向我的医生咨询”,作为符合逻辑的答案,这可能会导致结果偏倚。
病史问题:病史问题应在自主选择问题后提出,以防止因提示受试者关注特定的标签信息而出现结果偏倚。病史问题应易于消费者理解,并以获取与药物的适应症、警告和禁忌症相关的健康状况信息为基础。
申办者有时会选择添加一个问题,询问受试者是否会购买该药物。FDA认为购买决定数据不能替代自主选择数据,因为购买决策可能受到个人病史以外的因素影响,例如费用或消费者家庭中其他人的需求。如果申办者希望收集有关购买决定的数据,应该在完成自主选择评估部分后再提出这些问题。
2.4.2 问卷设计总体理念
以下是关于问卷设计的一般性建议。
应使用简单的词汇,并预先对问题进行测试,以确保问题能引出想要的信息。
有些问题应该是直接、具体和明确的,并且应该针对单个事项或问题。
有些问题应该涉及更高层次的理解力,可能需要受试者综合理解几条标签信息才能得到正确的回答。
问题的前后顺序应得当,以确保问题中包含的信息不会影响受试者回答后续问题。
选择题的答案应该是独立的,并且只包含一个正确答案。
在选择题(如评估病史的问题)的选项中,“我不知道”应该被列为选项之一,以允许受试者承认他们不知道,从而避免猜测。选项中还应包括“其他”,以允许受试者添加一些可能未列为选项的内容。
不应使用旨在衡量受试者行为意图的问题。行为测试超出了自主选择研究的范围。如果需要获得受试者在真实环境下的行为情况信息,应该开展相关的实际使用研究。
问卷可以预先进行测试,预测试人群应与目标人群相似,以确保通过问卷能获得想要的信息。
2.5 研究的开展
研究的宣传招募信息不应包含任何有关拟用药品的信息。如果在开始阶段有电话沟通,受试者应该只收到关于如何以及在哪里参与研究的信息。个别时候,研究地点可能需要选在医疗机构,以便获得特定人群。研究环境应该舒适,光线充足,便于阅读。受试者应有足够的时间阅读标签,并且在整个测试期间内可以查看标签信息。但是,在测试过程中不应提示受试者阅读标签。
应给与受试者足够的指导,让其了解研究的形式和开展方式,以及参与研究可能所需的时间。实施问卷调查的方法主要包括两种:自行填写或由经过培训的调查员进行提问。使用调查员可以降低识字水平较低的受试者回答错误的机率,因为他们可能理解了标签的信息,但无法读懂问题。然而,使用调查员可能会导致偏倚,特别是当调查员引导受试者来获得答案时。因此,调查员应接受充分的培训,并应遵循既定的方案和(或)读本。任何数据收集方法都可能产生固有偏差,因此,申办者应提供选择特定方法的理由,并应解决所有潜在的偏倚。
2.6 验证自主选择决策
自主选择问题的答案可以通过多种方式验证。有时可以通过询问病史来完成,但有时也需要收集实验室数据或进行体检。并非每项研究都需用到所有这些验证方法。
2.7 数据收集和记录
对于开放式问题的回答应该一字不差地完整记录。应事先详细规定开放式问题答案的文本编码、分类和分析的程序,并在研究方案中加以说明。此外,应预先设定针对封闭式问题的所有正确和错误的答案。应记录开放式问题的所有事后编码。
验证研究数据的记录完整性及准确性的方法应在研究方案或统计分析计划中说明(即受试者的回答、数据录入、缺失数据和数据编码)。
03、最终报告
最终报告应概述研究设计、研究活动及对研究结果的解读。报告应评估是否招募了适当的人群,以充分评估自主选择决策。报告还应该描述招募工作的性质和响应率(即经筛选实际参与研究的受试者的比例)。如果可能,应该描述被排除在外或选择不参与研究的潜在受试者的人口统计学特征和不参与的原因。对于入组的受试者,应描述其相关的人口统计学特征(包括识字水平),以及他们是否完成了完整的研究。最终报告中应描述受试者未能完成研究的原因。
研究结果的表述应包括总体正确自主选择率和相关亚组(例如,识字水平、性别、年龄、种族和存在高风险因素)的正确自主选择率。
正确自主选择的可接受成功标准应基于研究开始前制定的、记录在方案和(或)统计分析计划中的成功标准。通过开放式、非引导性问题获得的用于评估自主选择的回答文本应用于加强对定量数据的解读。因此,应提供对定量和定性数据类型的分析,以支持和解读研究成果。
04、小 结
“自我药疗”是非处方药品属性的体现,美国FDA的非处方药自主选择研究行业指导原则介绍了自主选择研究中研究设计、方法学研究和分析的一般原则,此研究简单、易行、成本低,也为非处方药说明书内容的修订提供了依据。目前我国非处方药转换及注册方面,无相关指南或指导原则指导企业开展自主选择研究,FDA的自我选择研究行业指导原则可以作为行业参考,使企业对于自己的产品是否适合申报非处方药有初步的了解,并有利于企业更好地开展说明书修订工作。

来源:中国食品药品监管杂志


