您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-04-08 19:39
1. 英国的立法是什么?
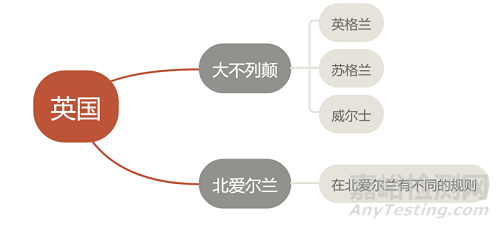
关于英国
英国的立法:UK MDR 2002
UK Medical Devices Regulations 2002(SI 2002 No 618, as amended)
|
大不列颠(GB) |
Part II: general medical devices |
MDD |
|
Part III: active implantable medical devices |
AIMDD |
|
|
Part IV: in vitro diagnostic devices |
IVDD |
|
|
EU MDR 以及 EU IVDR 不适用于大不列颠
|
||
|
北爱尔兰(NI) |
EU MDR 于2021年5月26日起适用 |
|
|
EU IVDR 将于2022年5月26日适用 |
||
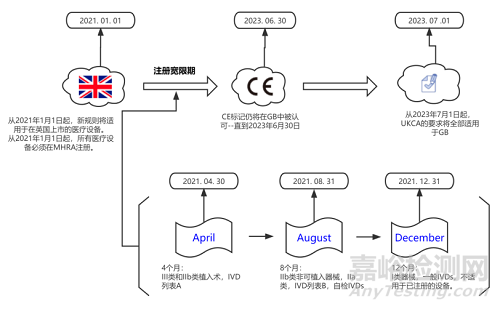
2. UK MDR 2022的实施时间


3. 制造商需要在什么时候采取行动?
4. 英国负责人(UKRP)
谁是UKRP
—如果制造商位于英国以外,是必须的
—代表制造商行事
—UKRP任命符合设备注册的宽限期
主要职责
—设备注册
—确保关键文件可用(如文档,技术文档,相关证书)
—确保进行适当的合格评定
与主管当局配合
—立即报告事件和投诉
—配合MHRA
—保留重要文件的副本
—提供MHRA进口商名单
标签
—UKCA标记的设备上需要UKRP的名称和地址(如适用)
5. 英国批准机构 (UKAB)
什么是英国批准机构?
—由药品和保健产品监管机构(MHRA)指定的组织,负责评估制造商及其医疗器械是否符合2002《医疗器械条例》(经修订的SI 2002 No 618)的要求。
—根据英国MDR 2002的第II、III、IV部分进行的GB评估
—根据EU MDR或EU IVDR对NI进行评估
—原设在英国的欧盟国家统计局自动成为UKAB(自2021年1月1日起)
—NANDO被UKMCAB(英国市场合格评定机构)取代
6. 在北爱尔兰市场投放产品
NI有什么不同?
—脱欧协议的一部分
—与爱尔兰(欧盟的一部分)没有硬边界
爱尔兰岛上建立单一监管和贸易区
—EU MD法规适用于NI
—EU MDR(2021年5月26日),EU IVDR(2022年5月26日)
—进入NI市场需要CE标记(如果有UKAB,需要UKNI标记)
NI企业“自由”进入GB市场
7. 北爱尔兰的法规要求
向MHRA注册设备
A. 大多数设备都需要注册
—第I类仪器、定制仪器及一般IVD除外-已在欧盟CA *仅适用于NI市场
B. 2021年1月1日: I类设备、定制设备和一般IVD
C. 2021年5月1日: III类和IIb类可植入产品,以及所有主动可植入医疗设备和IVD List A产品
D. 2021年9月1日: 其他IIb类和所有IIa类设备和IVD清单B产品和自检IVD
UKRP和授权代表
A. 如果制造商位于英国以外,UKRP要求
—包括欧盟、欧洲经济区和欧盟第三国
—如果EU AR位于NI - UKRP不需要
B. 需要从2021年1月1日起生效
C. GB制造商将需要EU或NI AR
D. 向MHRA注册设备
—由UKRP或NI AR
E. 单一实体可以是基于NI的UKRP和AR
标签
A. 接受CE标志(EU NB)
B. 接受UKNI标记(如果涉及UKAB)&同时有CE
C. 欧盟不接受CE + UKNI
D. *不受限制地访问GB
—NI MFRs可访问GB
—NI的CE访问继续进行>2023年6月30日
E. UKAB的评估在欧盟不被认可
F. UKNI不被欧盟接受

来源:德大器械产业管家


