您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-21 10:45
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.Keytruda/Lenvima获中国台湾批准治疗肾癌。卫材口服多受体酪氨酸激酶抑制剂Lenvima(仑伐替尼)与默沙东PD-1疗法Keytruda的联合用药方案,在中国台湾获批用于一线治疗晚期肾细胞癌。在一项Ⅲ期临床CLEAR(Study 307/KEYNOTE-581)中,与舒尼替尼相比,Keytruda+Lenvima组合使死亡风险降低34%(HR=0.66[95%CI:0.49-0.88];p=0.0049),使疾病进展或死亡风险降低61%(HR=0.39;p<0.0001),并显著延长PFS(中位数:23.9个月vs 9.2个月)和提高ORR(71%vs 36%;p<0.001)。
2.迪哲JAK1抑制剂获FDA快速通道资格。迪哲医药口服JAK1特异性抑制剂DZD4205(golidocitinib)获FDA授予快速通道资格,用于治疗复发/难治性外周T细胞淋巴瘤(r/r PTCL)患者。在一项Ⅰ/Ⅱ期临床中,DZD4205在这类患者中的缓解率达到42.9%(n=21/49),完全缓解率为22.4%;而且对多种PTCL亚型都有良好的疗效。DZD4205具有良好的安全性,有潜力治疗多种血液肿瘤、实体瘤和自身免疫性疾病。
3.沃森二价HPV疫苗即将获批上市。沃森生物子公司玉溪润泽的重组人乳头瘤病毒双价(16/18型)疫苗的上市申请审评状态已变更为“在审批”,即将获批上市,用于预防由HPV 16型和18型病毒感染导致的子宫颈癌。目前,全球已上市销售的HPV疫苗包括英国葛兰素史克公司的二价HPV疫苗、默沙东的四价HPV疫苗和九价HPV疫苗以及我国厦门万泰沧海生物的二价HPV疫苗。
4.葆元双靶点TKI拟纳入突破性治疗品种。葆元医药开发的新一代ROS1/NTRK抑制剂AB-106胶囊(taletrectinib)获CDE拟纳入突破性治疗品种,用于治疗携带ROS1融合基因且未经ROS1-TKI治疗的非小细胞肺癌。在一项II期临床中,在未接受过克唑替尼治疗的21例患者中,经确认的ORR为90.5% ,DCR为90.5%;在克唑替尼经治患者中,这两数值为43.8%和75.0%;在脑转移患者中,研究者评估的颅内客观缓解率为83.3%。taletrectinib总体耐受性良好。
5.再鼎双靶点TKI纳入突破性治疗品种。再鼎医药新一代酪氨酸激酶抑制剂(TKI)repotrectinib获CDE纳入突破性治疗品种,用于未接受过ROS1 TKI治疗的ROS1阳性转移性非小细胞肺癌。repotrectinib是Turning Point公司开发的一款ROS1/NTRK抑制剂,此前已获FDA授予突破性疗法认定、孤儿药资格,以及4项快速通道资格。在中国,repotrectinib正加入一项国际Ⅱ期临床TRIDENT-1,评估repotrectinib治疗ROS1阳性晚期NSCLC和NTRK阳性晚期实体瘤的潜力。
6.翰森制药双靶点降糖药启动临床。翰森制药GLP1R/GIPR双重激动剂HS-20094首次登记启动一项Ⅰ期临床,在健康受试者中评价HS-20094单次和多次皮下注射给药的安全性、耐受性、药代动力学和药效动力学。HS-20094是国产第3款启动临床的双靶点降糖药。当前进展最快的是信达与礼来合作的GLP-1R/GCGR双重激动剂IBI362,已启动针对2型糖尿病和肥胖症的Ⅱ期临床,信达预计在2022年推进其关键注册临床。
国际药讯
1.FIC丙酮酸激酶激活剂获批上市。Agios公司“first-in-class”口服丙酮酸激酶激活剂Pyrukynd(mitapivat)获FDA批准上市,用于治疗患有丙酮酸激酶(PK)缺乏症,且出现溶血性贫血的成人患者。Pyrukynd也是丙酮酸激酶缺乏症的首个疾病修正疗法。在两项关键性Ⅲ期临床(ACTIVATE和ACTIVATE-T)中,该疗法为需要定期输血的患者显著减少输血的负担;在没有定期接受输血的患者体内显著提高血红蛋白的水平。
2.拜耳前列腺癌新药Ⅲ期临床成功。拜耳口服雄激素受体抑制剂Nubeqa(darolutamide)治疗转移性激素敏感性前列腺癌(mHSPC)的Ⅲ期临床结果积极。在雄激素剥夺治疗(ADT)+多西他赛的基础上,darolutamide较安慰剂显著提高患者的总生存期,使患者死亡风险降低32.5%(HR=0.68,95% CI:0.57-0.80;P<0.001)。随访为4年时,darolutamide组的总生存率为62.7%,对照组为50.4%。研究成果已在《新英格兰医学杂志》上发表。
3.新一代抗抑郁药Ⅲ期临床成功。Biogen与Sage公司联合开发的新一代GABAA变构调节剂Zuranolone(SAGE-217),在治疗重度抑郁障碍的Ⅲ期临床CORAL到达主要终点。与安慰剂+ADT(标准疗法)治疗组相比(n=215,基线评分26.6),zuranolone+ADT治疗组(n=210,基线评分26.8)在口服治疗第3天的HAMD-17评分较基线的变化有显著的差异(-8.9±0.39 vs -7.0±0.38,p=0.0004 )。次要终点方面,两组在第8天、第12天均显示更优的评分改善,不过第15天的改善不具有显著性。CORAL研究结果与LANDSCAPE项目下其他的临床数据相一致。
4.百时美施贵宝CAR-T获优先审评资格。FDA授予百时美施贵宝(BMS)CD19-CAR-T疗法Breyanzi(lisocabtagene maraleucel)的补充生物制品许可申请(sBLA)优先审评资格,用于治疗一线治疗失败后的复发/难治性大B细胞淋巴瘤(R/R LBCL)。在一项关键性Ⅲ期临床中,在中位随访为6.2个月时,Breyanzi治疗组中位EFS为10.1个月,标准治疗组为2.3个月(p<0.0001)。此前,FDA已批准Breyanzi用于治疗接受过两种或以上系统治疗的R/R LBCL。
5.杨森达成超10亿美元合作。强生旗下杨森与Remix Therapeutics将利用后者的REMaster药物发现平台,合作开发调节RNA加工的小分子候选药物,以应用于免疫学和肿瘤学领域。Remix通过对RNA加工过程进行重编程,创新设计出可以选择性降解RNA的口服小分子。根据协议,Remix将获得4500万美元的前期付款和里程碑后期付款、以及合作产品的销售分成,潜在总金额可能超过10亿美元;杨森将获得三个特定靶点的独家权益。
6.罗氏布局大脑渗透性口服药。Aquinnah公司与罗氏达成研发协议,联合推进前者大脑渗透性口服小分子来治疗肌萎缩侧索硬化(ALS)和其他神经退行性疾病。Aquinnah利用应激颗粒(stress granule)生物学、RNA结合蛋白和双分子凝聚物形成等新兴技术开发的小分子化合物,旨在减少TDP-43病理,改善ALS的神经元细胞存活率。根据协议,罗氏将负责先导候选药物的研究,开发和全球商业化。
医药热点
1.《医疗机构检查检验结果互认办法》出台。2月14日,为进一步提高医疗资源利用率,减轻人民群众就医负担,保障医疗质量和安全,国家卫健委等四部门联合印发《医疗机构检查检验结果互认管理办法》。医疗机构及其医务人员应当在不影响疾病诊疗的前提下,对标有全国或本机构所在地区互认标识的检查检验结果予以互认。鼓励医务人员结合临床实际,在不影响疾病诊疗的前提下,对其他检查检验结果予以互认。
2.国家卫健委部署新冠疫苗序贯接种。在2月19日的国务院联防联控机制发布会上,国家卫健委疾控局副局长吴良有介绍,根据新冠病毒疫苗研发使用进展情况,接种策略得到进一步补充和完善。经国务院联防联控机制批准,国家卫健委已开始部署序贯加强免疫接种。序贯加强免疫接种,是指在加强免疫时选择不同于灭活技术路线的新冠疫苗。此前,我国一直实施同源加强免疫的接种策略。
3.Robert Califf再次出任FDA局长。美东时间2022年2月15日,Robert Califf以50票对46票的微弱优势被美国参议院确认为FDA的新负责人。Califf曾于2016年2月至2017年1月担任FDA局长。在此前的391天里,FDA由Janet Woodcock临时执掌。在重新加入FDA之前,Califf 博士是Alphabet Inc.的医疗战略主管和高级顾问,为其健康子公司Verily Life Sciences和Google Health的战略和政策做出了贡献。
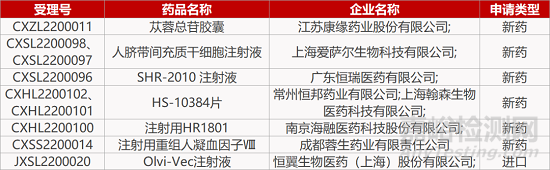
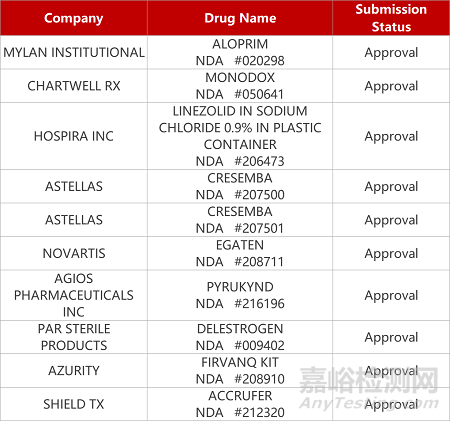
评审动态

来源:药研发


