您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-01-21 19:44
去年12月10日国家局综合司已经公开征求《GB 9706.1-2020及配套并列、专用标准实施细则(征求意见稿)》意见。根据征求意见稿的内容,目前与GB9706.1-2020配套的7个并列标准已全部发布,专用标准正逐批发布。关于GB 9706.1-2020及配套并列标准实施日期,在征求意见稿中也分为两不同的时间点。
(一)若产品不涉及专用标准,GB 9706.1-2020及配套并列标准实施日期均为2023年5月1日。
(二)若产品涉及附表中GB 9706.1-2020配套专用标准(名称中带“专用要求”的标准),除专用标准实施有特殊要求外,GB 9706.1-2020及配套并列标准原则上与相关专用标准同步实施。
举例来说,YY 9706.252-2021《医用电气设备 第2-52部分:医用病床的基本安全和基本性能专用要求》的实施日期是2024年5月1日。病床类产品执行GB 9706.1-2020及并列标准(如YY 9606.102-2021)的日期就需要跟随专用要求的日期,也就是2024年5月1日。虽然部分产品的准备时间又多了一年,但考虑到2020版标准和2007版标准之间较大的差异以及后续检测资源,为了平稳过渡到新版标准,还是建议大家及早策划,做好各项准备工作。
为了让大家更好地理解新版标准的主要变化,我们打算从以下的六个主题来进行介绍。
· 综述
· 风险管理
· 基本性能
· 电气安全
· 机械安全
· 其它
已发布的GB 9706.1-2020标准是按照IEC 60601-1 3.1版(2012)的内容进行修改转化的。新版标准将GB 9706.15《医用电气设备 第1-1部分:安全通用要求并列标准:医用电气系统安全要求》(对应IEC60601-1-1)和YY/T 0708《医用电气设备 第1-4部分:安全通用要求并列标准:可编程医用电气系统》(对应IEC60601-1-4)合并到GB9706.1-2020标准的第14章和16章。
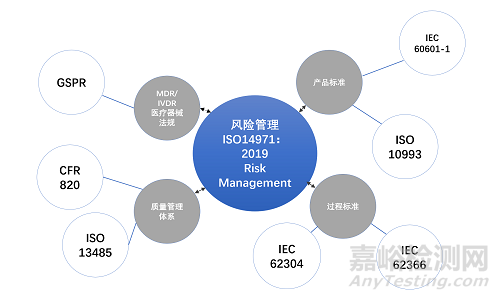
与GB 9706.1-2007相比, 新版标准最大的变化就是引入风险管理这一概念,并且要求进行基本性能的评定。仅仅考虑基本安全已经不足够,还需要产品的基本性能。其中,风险管理过程的通用要求在标准的4.2中被引入。
考虑到ME设备(医用电气设备)或ME系统与患者,操作者和周围环境的特殊关系,将基本安全标准和ISO/IEC导则纳入考虑并与之保持一致。新版标准在电击防护要求上对于操作者和患者的防护有所区别(MOOP与MOPP)。第8章将电气安全相关的要求重新编制。标准根据信息技术(ITE)设备GB4943.1的要求引入对操作者的防护措施(MOOP)的概念并引入高海拔、高性能绝缘材料、污染等级、过压类别等概念。
第9章关于机械危险的防护已经修订为更广范围,可以降低ME设备可能对于患者或操作者产生的危险。
15.3中规定了ME设备受到推力、冲击、坠落和粗鲁搬运而产生应力时的机械强度要求。
2007版标准第六篇中的关于易燃麻醉混合气体的防护在新版标准中被移至规范性附录中。这是因为这类易燃麻醉气体在临床中的使用非常少,但部分制造商仍会提供此类 ME设备。该附录作为资料性参考。
GB9706.1-2020标准已于2020年四月发布,并将在明年5月份实施。根据目前我市医疗器械企业广泛需求,苏州市医疗器械行业协会法规部现为企业提供GB9706.1-2020标准符合性的整体解决方案,包括产品安全评估、定制化摸底测试、测试认证等。
GB 9706.1-2020版标准最大的变化之一是引入了风险管理概念。作为第一个在IEC标准中引入风险管理概念的标准,其部分条款需要结合风险管理过程来判定符合性。之前版本GB 9706.1是否考虑过风险管理部分的内容呢?答案是肯定的,只不过这部分的工作是由标准的起草者代替大家完成了而已。起草者制定了风险可接受准则并转化为标准中明确的测试条件、测试结果限值、结构要求等具体要求。
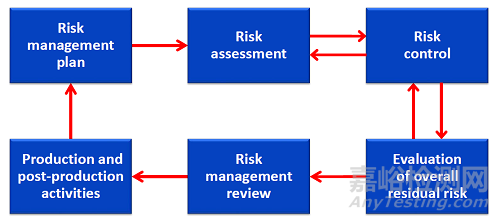
引入风险管理过程是为了达到以下目的:
a)确定标准第5至17章的要求以及适用的并列和专用标准中的要求是否考虑特定的ME设备或ME系统的相关危险。
b)确定标准规定的某些试验以何种方式应用到特定的ME设备或ME系统。
c)若标准针对特定危险或危险情况没有明确具体的风险可接受准则,则应建立风险可接受准则并评估剩余风险。
d)通过比较替代的风险控制措施后的剩余风险与执行标准相关要求后的剩余风险,来评价替代的风险控制措施的可行性。
GB 9706.1-2020中涉及的风险管理过程仅限于ME设备或ME系统的型式试验部分内容。也就是说,标准规定风险管理过程需要符合YY/T 0316的相关要求,但并不包括YY/T 0316中的所有要素。下述要求并不适用于GB 9706.1:
生产和生产后活动
定期复审风险管理过程的适宜性
风险管理的符合性可通过文件检查和过程评估来实现。在应用任何YY/T 0316要求时:
—术语“医疗器械”应假定与ME设备或ME系统是相同的意思。
—YY/T 0316中涉及的术语“故障状态”应包括,但不仅限于本标准中定义的单一故障状态。
GB9706.1-2020标准规定的是适于ME设备或ME系统相关风险的通用要求,她有助于加强风险管理过程的建立。风险管理过程旨在识别GB9706.1标准所涉及的危险,以及所有与风险和风险控制措施有关的危险。
标准的条款中定义了一些引发危险情况的情形或故障。在这些情况下,通常需要进行风险管理过程以确定实际的危险情况是什么,并通过试验来证明在特定的情形下此危险情况是不会发生的。
有时候,制造商可能无法保证组成ME设备和ME系统的每一个组部件都遵循标准的所有过程,例如专用部件、非医用的子系统、设备。在这种情况下,制造商需要特别考虑额外的风险控制措施。
新版标准中免除不可接受风险的要求的同时也指出应依据制造商确定风险可接受准则来确定可接受和不可接受风险。并不是所有与ME设备和ME系统有关的风险都在标准中明确了相关的要求。
应通过检查文档来明确:
—制造商确定的风险可接受准则来检查是否符合要求。
—通过检查ME设备或ME系统考虑中的风险管理计划来判定是否符合要求。
—确认制造商具备风险管理文档且已经考虑标准中对特殊ME设备或ME系统特定要求。
如何识别风险源呢?当评价风险时,制造商应用下述方法来应用标准的要求:
a)针对某些特定的危险或危险情况提出要求及其可接受准则,符合这些要求可推定剩余风险已经降低到可接受水平,除非有相反的证据。
b)标准针对某些特定的危险或危险情况提出了要求,但不提供具体的可接受准则。依据风险管理计划中的风险可接受准则来判定剩余风险是否可接受。
比如载荷和液体泼洒试验的试验条件。
c)标准定义的特定危险或危险情况:
制造商应确定特定的ME设备或ME系统是否存在这些危险或危险情况,和特定的ME设备或ME系统存在这些危险或危险情况,制造商应评价和通过实施4.2.2规定的风险管理过程来控制这些风险。
针对特定的ME设备或ME系统的危险或危险情况,如在标准中未明确相应要求,制造商应按4.2.2的规定在风险管理过程中提出那些危险。
考虑到标准是落后于科学技术发展的,在标准规定的特定风险控制措施或试验方法之外,针对新技术、新应用,有时候替代的风险控制措施或试验方法也是可行的。例如,制造商可以通过提供科学数据或临床评价或比较研究来证明运用替代的风险控制措施或替代的试验方法所得到的剩余风险仍然是可接受的,且与应用标准中的要求所得到的剩余风险可比。
好消息是,据说在IEC 60601-1第四版的制定计划中,正在考虑弱化风险管理在标准中的地位和比重。
GB9706.1-2020标准已于2020年四月发布,并将在明年5月份实施。根据目前我市医疗器械企业广泛需求,苏州市医疗器械行业协会法规部现为企业提供GB9706.1-2020标准符合性的整体解决方案,包括产品安全评估、定制化摸底测试、测试认证等。

来源:苏州市医疗器械行业协会


