您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-24 12:21
2021年03月13日,CDE发布了《皮肤外用化学仿制药研究技术指导原则(试行)》,对比2018年07月11日发布的《新注册分类皮肤外用仿制药的技术评价要求(征求意见稿)》可以发现试行版删除了征求意见稿中的附件内容,即体外释放试验、体外透皮试验相关内容。只提出“体外透皮试验建议参考国内外相关指导原则(见参考文献 13、 15、 21、 22、 23)开展相关研究工作。”
本文对体外透皮试验相关指导原则中的内容进行整理如下。
一、体外透皮试验方法IVPT
(EMA指南提出IVPT适用于药物通过皮肤扩散并可在中受体细胞中定量的情况。)
1. 试验样品及次数

*应至少比较一个批次的受试制剂及对照 制剂;
*预试验中为评估IVPT方法的选择性,还应平行考察第三种不同于对照制剂的处方(类似EMA阴性制剂);
**如,用规格为目标产品规格50%的处方;
***体外透皮试验需进行重复设计,对照制剂、受试制剂、阴性制剂最少试验次数为24次;
***每次重复试验时,对照制剂、受试制剂、阴性制剂应使用同一供体皮肤进行测试,最好从相邻位置取样(同3.2 皮肤种类及要求相关内容);
***皮肤供体数量≥12(如提供合理性论述,也可<12),每个供体至少重复2次。
2. 试验时间

*试验时间满足透皮研究需要,同时最小化对透过曲线有影响的变化,如皮肤完整性、反向扩散、剂量损失或转移等
3. 试验条件
(阿昔洛韦个药指南提出:体外透皮试验环境控制条件为温度21℃±2℃,相对湿度50%±20%RH;)
3.1 装置

*实验室需要鉴定安装皮肤的孔口的扩散面积、每个扩散池接收室的体积
3.2 皮肤种类及要求

*①应评估皮肤屏障的完整性,如氚水渗透、经表皮失水(TEWL)、皮肤电阻抗/电导;
*②记录皮肤厚度,保持研究中皮肤厚度的一致性/在规定范围内;
*③建议每个皮肤供体至少分别为对照制剂及受试制剂提供4个重复的皮肤切片;
*④每个试验组每个供体的皮肤切片数量应相同。
**①应在同一供体皮肤上进行对照制剂、受试制剂、影响制剂的透皮研究;
**②建议供体数量≥12,如提供合理性论述,也可<12;
**③试验前后检查皮肤完整性及可接受标准;
**④体外透皮试验需进行重复设计。每次重复试验时,对照制剂、受试制剂、阴性制剂应使用同一供体皮肤进行测试,最好从相邻位置取样(同1 试验样品及次数相关内容)
3.3 皮肤部位

3.4 交替给药

3.5 制剂用量

3.6 介质温度

3.7 透皮介质

*需考虑介质的组成及pH值
**应确认透皮试验期间及进样分析前药物在介质中的稳定性。
3.8 介质用量

*漏槽条件:药物接收介质中达到的最大浓度不超过其在接收介质中最大溶解度的30%。漏槽条件通常发生在至少是饱和体积3-10倍的介质中
3.9 转速

3.10 取样点

3.11 补液

3.12 累积透过量

4. 透皮试验方法验证
说明:EMA要求选择最有区分力的测试条件

*控制程序,无需验证
**根据预实验绘制出的完整曲线,以确定最大速率、取样时间及取样频率
5. 数据分析/等效性评价

*小规格及有限扩散制剂暂不纳入考虑
*重复设计试验进行数据分析前,对同一供体重复位点获得的结果取平均(几何平均)
6. 资料撰写
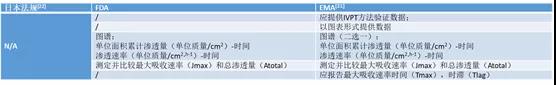
二、其他控制措施

三、参考文献
说明:参考文献[22][15][21]编号按照文献[1]中参考文献编号整理
[1] CDE, 皮肤外用化学仿制药研究技术指导原则(试行)
[22]PMDA, 局所皮膚適用製剤(半固形製剤及び貼付剤)の処方変更のための生物学的同等性試験ガイドラインについて。2010 年 11 月
[15] FDA,Draft Guidance on Acyclovir, December 2016
[21] EMA,CHMP: Draft guideline on quality and equivalence of topical products. December2018

来源:Internet


