您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-03 10:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
特瑞普利单抗在美报两项BLA。君实生物特瑞普利单抗完成向FDA滚动提交两项生物制品许可申请(BLA),联合吉西他滨/顺铂一线治疗晚期复发或转移性鼻咽癌和单药用于治疗经治的复发或转移性鼻咽癌。特瑞普利单抗是中国首个获批上市的国产PD-1单抗,已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤领域获得FDA授予2项突破性疗法认定、1项快速通道认定和3项孤儿药资格。美国尚无PD-1单抗获批用于鼻咽癌的治疗。
国内药讯
1.泽布替尼在美获批新适应症。百济神州泽布替尼(百悦泽, Brukinsa)获FDA批准第二项适应症,用于治疗成年华氏巨球蛋白血症(WM)患者。百悦泽是一款由百济神州自主研发的BTK抑制剂,目前正在全球进行广泛的临床试验,作为单药和与其他疗法联合治疗多种B细胞恶性肿瘤。根据该公司半年报,该药第二季度销量2.7亿元,半年销售额超4亿元,同比增长737%。
2.再鼎医药Qinlock®在台获批上市。再鼎医药宣布,台湾药监部门批准Qinlock®(注:中国大陆注册商品名:擎乐®,台湾地区注册商品名:期樂®)的新药上市申请,用于治疗已接受过伊马替尼在内的3种及以上激酶抑制剂治疗的晚期胃肠间质瘤(GIST)成人患者。Qinlock®可广泛抑制已知驱动GIST的KIT和PDGFRα突变激酶。目前该新药正在Ⅲ期临床INTRIGUE中评估用于二线治疗GIST的潜力,预计今年第四季度发布主要数据。
3.艾博/沃森新冠mRNA疫苗获批III期临床。沃森生物与艾博生物合作研发的新冠mRNA疫苗ARCoVaX(ARCoV)III期临床日前分别在墨西哥、印度尼西亚获批。ARCoV由脂质纳米粒(LNPs) 包裹,靶向SARS-CoV-2棘突蛋白RBD区域。在临床前研究中,100μg剂量可诱导高水平中和抗体,1000μg剂量无明显的不良反应;单剂或两剂ARCoV免疫可在小鼠和非人类灵长类动物中激发抗多种流行SARS-CoV-2毒株的强大抗体和T细胞应答。该疫苗是中国首个获批进入临床的新冠mRNA疫苗。
4.开拓普克鲁胺治疗新冠获批III期临床。开拓药业AR拮抗剂普克鲁胺片获国家药监局两项临床试验默示许可,拟III期临床用于新冠肺炎的治疗。这两项试验均为全球多中心临床试验,其中一项(NCT04869228)在中国、巴西、马来西亚、菲律宾等国家治疗轻中度COVID-19男性患者,而另一项(NCT05009732)在美国、中国、南美洲(包括巴西)、欧洲及印度等国家治疗重症住院COVID-19患者。
5.广州麓鹏LP-168上I期临床。广州麓鹏制药抗肿瘤新药LP-168片完成I期临床首例患者给药。该项研究评估LP-168用于复发或难治B细胞淋巴瘤治疗的安全性与耐受性,由北京肿瘤医院的朱军教授与宋玉琴教授担任主要研究者。LP-168是新一代肿瘤抑制剂,具有独特的作用机制,能够同时抑制野生型靶点蛋白及其耐药突变体。该公司近日提交的新的临床试验申请也已获CDE受理。
6.信达购进KRAS抑制剂权益。信达生物与劲方医药达成授权协议,获得后者KRAS G12C抑制剂GFH925在中国(中国大陆、香港、澳门及台湾)的全球独家开发和商业化权利,并拥有全球开发和商业化权益的选择权。劲方医药将获2200万美元首付款和累计不超过5000万美元的全球开发支持费用。如果信达生物行使全球权益的选择权,劲方医药还将获得总额不超过2.4亿美元的全球开发、注册及销售里程金,以及产品的销售分成。
7.先声购进抗肿瘤新药全球权益。先声药业与阿尔脉生物就抗肿瘤新药ALM005签署独家许可协议。LM005是基于阿尔脉生物的AI技术发现的拟用于癌症治疗的候选化合物分子。根据协议,先声药业将获得ALM005全球范围内所有适应症的开发和商业化权益。
国际药讯
1.杨森精神分裂症长效疗法获批上市。FDA批准强生旗下杨森长效非典型抗精神病药物Invega Hafyera(棕榈酸帕利哌酮)上市,用于治疗成人精神分裂症。这是FDA批准治疗该病的首款只需每年给药2次的注射药物。在一项Ⅲ期临床中,与活性对照组相比,Invega Hafyera在首次疾病复发所需时间的主要终点上达到非劣效性标准,两组在12个月中无复发的患者比例分别为92.5%和95%。
2.默沙东molnupiravir上抗新冠Ⅲ期临床。默沙东与Ridgeback公司联合开发的口服抗新冠病毒药物molnupiravir(MK-4482/EIDD-2801)启动了一项国际Ⅲ期临床MOVe-AHEAD(MK-4482-013,NCT04939428)。将在年龄≥18岁、与经实验室确认且有症状的COVID-19感染者居住在同一个家庭的受试者中,评估暴露后预防COVID-19感染的有效性。主要终点为14天期间发生COVID-19的参与者百分比、发生不良事件的参与者百分比、因不良事件中止研究干预的参与者百分比。
3.糖皮质激素软膏眼疾Ⅱ期临床结果积极。AxeroVision公司每日一次给药的创新糖皮质激素乳膏AXR-270,在治疗与睑板腺功能障碍(MGD)相关干眼症(DED)的Ⅱ期临床获积极结果。AXR-270(0.2%乳膏和2%乳膏)均具有极好的安全性和耐受性;AXR-270 0.2%乳膏治疗组患者第8天时的眼干度评分(EDrS; p<0.001)、眼部不适评分(EDiS; p<0.001)、角膜总染色(tCFS; p<0.001),以及治疗14天内的泪膜破裂时间(TBUT; P<0.01)相较基线,均具统计学意义的显著改善。
4.Neurogastrx拟加速开发胃肠疾病新药。Neurogastrx公司完成6000万美元的B轮融资,以用于推进其针对胃肠道(GI)严重疾病的研发管线(fexuprazan和NG101)。Fexuprazan是一款处于后期临床的在研新型钾离子竞争性酸阻滞剂(P-CAB),拟用于治疗糜烂性食管炎(EE);NG101是一款作用于外周神经的选择性多巴胺D2受体拮抗剂,拟用于治疗胃轻瘫。
5.Asher拟加速开发创新IL-2疗法。Asher Biotherapeutics宣布完成1.08亿美元的B轮融资,以推进其顺式靶向技术开发的靶向激活CD8阳性T细胞的IL-2免疫疗法AB248,通过临床概念验证。在临床前研究中,AB248表现出高度差异化特征,在选择性激活与扩增CD8阳性T细胞的同时,几乎不激活与毒性和免疫抑制作用相关的免疫细胞亚型(如Tregs细胞),从而增强抗肿瘤疗效和改善耐受性。
6.多款JAK抑制剂存在安全性风险。FDA日前要求辉瑞Xeljanz、艾伯维Rinvoq以及礼来Olumiant明确标识,患者在接受治疗后具有心脏安全和致癌风险。这三种药物均属JAK抑制剂,此前已具有导致血栓和淋巴瘤的黑框警告。目前,FDA更改了这些药物在适应症治疗中的顺序位置,并将获批适应症中的使用,限制在已失败或不适合使用TNF阻滞剂治疗的患者。
医药热点
1.世卫组织设立流行病情报中心。当地时间9月1日,世卫组织总干事谭德塞为世卫组织流行病情报中心揭幕。该中心位于德国柏林,旨在更好地为全球提供数据、分析与决策,以发现并应对突发卫生事件,并将与全球共享数据。谭德塞表示,需要发现潜在的大流行病,并实时监测疾病控制措施,以建立有效的流行病风险管理体系。
2.贵州面向全国引进退休高级医卫人才。贵州省卫健委近日发布公告,决定继续面向全国引进一批退休高级医疗卫生人才,助力贵州医疗卫生事业高质量发展。此次,贵州省妇幼保健院、贵阳市第一人民医院等158家医疗卫生机构共提供临床医学等引才岗位579个,需求数量697人。
3.零售药店医保定点管理细则发布。湖南省医保局日前印发《湖南省零售药店医疗保障定点管理实施细则(试行)》,9月1日起施行。根据《细则》规定,如果要满足医疗保障定点申请条件,零售药店至少在注册地址正式经营3个月,至少有1名取得执业药师资格证书或具有药学、临床药学、中药学专业技术资格证书的药师。证书注册地址在该零售药店所在地,药师必须签订1年以上劳动合同,并且在合同期内。
评审动态
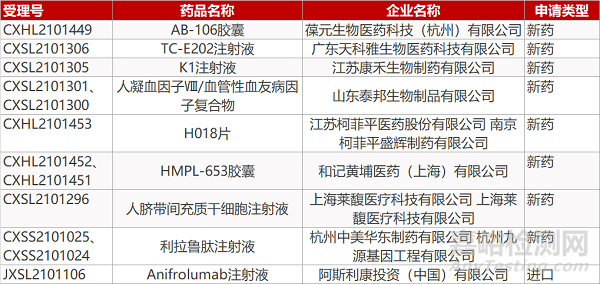
申请临床:
葆元生物的AB-106胶囊、广东天科雅生物的TC-E202注射液、江苏康禾生物的K1注射液、山东泰邦生物的人凝血因子Ⅷ/血管性血友病因子复合物(2个规格)、江苏柯菲平医药/南京柯菲平盛辉制药的H018片、和记黄埔的HMPL-653胶囊(2个规格)、海莱馥医疗/上海莱馥医疗的人脐带间充质干细胞注射液、阿斯利康的Anifrolumab注射液。
申请生产:
杭州中美华东制药/杭州九源基因工程的利拉鲁肽注射液。

来源:药研发


