您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-25 10:53
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
康方PD-1/CTLA-4双抗获优先审评。CDE受理康方生物PD-1/CTLA-4双抗Cadonilimab用于治疗复发/转移性宫颈癌的新药上市申请,并授予优先审评资格。Cadonilimab(AK104)是全球首个进入临床试验的PD-1/CTLA-4双抗,目前已在注册性II期临床中获得积极结果。在目标适应症人群中,与已上市PD-1单抗的公开数据相比,Cadonilimab显示出更优疗效的潜力。在美国,Cadonilimab用于上述适应症也获得快速审批通道资格和孤儿药资格。
国内药讯
1.晨泰医药新一代EGFR-TKI获批临床。晨泰医药1类新药zorifertinib片获国家药监局临床试验默示许可,拟开发用于治疗非小细胞肺癌(NSCLC)患者。zorifertinib是一款新一代EGFR-TKI药物,具有高达100%的血脑屏障透过率,目前正在一项国际多中心Ⅱ/Ⅲ期临床EVEREST(AZD3759-003)中评估治疗EGFR突变阳性NSCLC伴中枢神经系统(CNS)转移患者的安全性和有效性。EVEREST研究的主要研究者为吴一龙教授。
2.恒瑞SHR-1701注射液获批临床。恒瑞1类新药SHR-1701注射液获国家药监局临床许可,拟联合化疗用于复发或转移性鼻咽癌患者的治疗。SHR-1701是恒瑞自主研发并具有知识产权的抗PD-L1/TGF-βRII双功能融合蛋白,目前正在中国开展多项临床,适应症涉及恶性肿瘤、胰腺癌和非小细胞肺癌等。其中,针对晚期结直肠癌、晚期或转移性胃癌或胃食管结合部癌两项适应症的临床推进最快,处于III期临床阶段。SHR-1701在澳洲单药治疗实体瘤的临床也在同步进行中。
3.德琪「塞利尼索」获批国际II期临床。德琪医药塞利尼索(XPOVIO®)获国家药监局临床试验默示许可,即将在国内开展一项用于治疗骨髓纤维化(MF)患者的II期临床。这是一项国际II期临床,在中国以苏州大学附一院为牵头研究中心,计划在国内入组约20例既往接受过至少6个月JAK1/2抑制剂治疗的MF患者中,评估塞利尼索与医生选择(PC)治疗相比的安全性和疗效。
4.石药获康宁杰瑞HER2双抗国内授权。石药集团与康宁杰瑞就康宁杰瑞自主研发的HER2双抗KN026订立一项许可协议。石药旗下津曼特生物将获得KN026作为单药及联合KN046(PD-L1/CTLA-4双抗)在中国内地用于治疗乳腺癌及胃癌适应症的独家开发及商业化许可权;两家公司将共同开发KN026其他适应症;康宁杰瑞将获1.5 亿元人民币的预付款, 4.5亿元人民币开发里程碑付款和4亿元的销售里程碑付款,以及产品的销售分成。
5.欧康维视收购诺华两款眼科产品。欧康维视生物全资附属公司香港欧康维视与诺华订立资产购买协议,将出资3500万美元收购埃美丁(富马酸依美斯汀滴眼液)和贝特舒(盐酸倍他洛尔滴眼液)两款眼科药品在中国大陆地区的所有权益,并取得相应生产技术的转让。埃美丁是一款H1拮抗剂,适用于治疗过敏性结膜炎;贝特舒是一款β(1)选择性肾上腺素拮抗剂,适用于降低由慢性开角型青光眼或高眼压症引起的眼内压治疗。
国际药讯
1.首款mRNA新冠疫苗获FDA正式批准。FDA批准辉瑞与BioNTech公司联合开发的mRNA新冠疫苗COMIRNATY®(BNT162b2)上市,用于在16岁及以上的人群中预防新冠病毒感染。该疫苗也是首款获FDA正式批准的新冠疫苗,复星医药拥有其大中华区独家权益。目前,辉瑞和BioNTech还计划通过补充BLA获取16岁及以上的个人接种第三针或加强针的许可,以及计划在第二剂疫苗6个月随访数据后提交一份补充BLA,以获取FDA对12至15岁人群使用的全面批准。
2.KOR激动剂治疗瘙痒获FDA批准上市。FDA批准Cara Therapeutics和Vifor Pharma联合开发的Korsuva(difelikefalin)上市,用于治疗接受透析的慢性肾病(CKD)成人患者的中重度瘙痒。Korsuva是一款“first-in-class” κ阿片受体(KOR)激动剂,靶向外周神经系统。在两项关键性Ⅲ期临床中,与安慰剂相比,更多接受Korsuva治疗的患者在评估瘙痒的WI-NRS评分上改善超过3分。Korsuva也是FDA批准用于治疗这类患者的首款疗法。
3.双重SGLT抑制剂2项Ⅲ期临床积极。Lexicon公司口服SGLT1/2双重抑制剂sotagliflozin(商品名为Zynquista),在治疗2型糖尿病伴心力衰竭恶化或慢性肾病患者的2项Ⅲ期临床(SOLOIST和SCORED)中获最新数据。SOLOIST结果显示,sotagliflozin使伴有急性失代偿性心力衰竭(HF)的2型糖尿病患者复合心血管终点的绝对风险降低33%,HFpEF和HFrEF患者的疗效一致。SCORED结果显示,sotagliflozin联合标准治疗将伴有慢性肾病的2型糖尿病患者的复合心血管终点降低26%。安全性上,两项试验的总体耐受性与安慰剂相当。
4.CTLA-4融合蛋白防治免疫排斥获优先审评。FDA授予百时美施贵宝(BMS)免疫调节剂Orencia(abatacept)补充BLA优先审评资格,用于预防6岁以上、接受非亲属造血干细胞移植(HSCT)患者的中/重度急性移植物抗宿主病(aGvHD),PDUFA日期为2021年12月23日。在一项Ⅱ期临床ABA2中,Orencia较对照组显著降低重度aGvHD和相关发病率,显著增加无aGvHD生存率,且未增加疾病复发。Orencia是一款CTLA-4与Fc构成的融合蛋白,已获批用于治疗各种关节炎疾病。
5.辉瑞收购肿瘤免疫疗法研发公司。辉瑞与肿瘤免疫疗法研发公司Trillium达成一项收购协议,辉瑞将以22.6亿美元收购Trillium Therapeutics所有已发行股票。Trillium Therapeutics现拥有的两个先导分子TTI-622和TTI-621可阻断信号调节蛋白α(SIRPα)-CD47,它们是一种潜在“best-in-class”SIRPα-Fc融合蛋白,目前正处于Ⅰb/Ⅱ临床开发,主要用于复发/难治性淋巴恶性肿瘤的治疗,包括弥漫性大B细胞淋巴瘤(DLBCL)、外周T细胞淋巴瘤(PTCL)等。
6.武田拟开发脂质体递送基因疗法。Genevant Sciences公司与武田达成一项合作和许可协议,利用Genevant专有的脂质纳米颗粒(LNP)技术平台,共同开发用于治疗罕见肝脏疾病的新型非病毒载体基因疗法。根据协议,Genevant将获得高达3.03亿美元的前期和潜在里程碑付款,与未来产品的销售分成。而武田将拥有合作产品的开发和商业化独家权益。两家公司此前已针对肝脏星状细胞中特定靶标开发核酸治疗药物,以治疗肝纤维化。
医药热点
1.日本首次要求医院全力救治新冠患者。日本厚生劳动省和东京都政府23日宣布,基于修改后的感染症法,向都内所有医疗机构要求面向新冠患者确保病床并最大限度接收患者。这是鉴于感染者激增导致病床紧张而采取的应对措施,也是感染症法2月成立后,中央政府首次提出要求。针对不服从要求的医疗机构,政府部门将进行劝告或公示医院名单。
2.福建泉州新生儿实现“秒参保”。福建省泉州市新生儿“秒参保”便民服务项目启动。依托“泉州医疗保障”微信公众号或支付宝生活号,泉州建设了一套新生儿医保参保系统,可提供新生儿医保参保和缴费等医保在线服务。新生儿“秒参保”医保便民服务项目,以新生儿母亲参保信息为识别方式,让新生儿落户前也能参加居民医保。
3.八县市成为基层卫生健康试验区。国家卫健委日前印发《关于开展基层卫生健康综合试验区建设的通知》,确定8个县市为基层卫生健康综合试验区。这8个县市分别为山西省晋中市介休市、浙江省嘉兴市海盐县、安徽省淮北市濉溪县、福建省龙岩市长汀县、山东省潍坊市寿光市、河南省平顶山市郏县、四川省泸州市泸县、新疆维吾尔自治区伊犁哈萨克自治州新源县。
4.我国总和生育率低于国际警戒线。据央视网快看官方微博消息,第七次人口普查数据显示,2020年中国总和生育率是1.3,低于国际社会通常认为1.5的警戒线,被认为有跌入低生育率风险的可能。相关监测亦显示,中国今年的出生人口和生育水平仍然呈现走低趋势。分析认为,生养教成本高是不想生育的重要因素。
评审动态
申请临床:
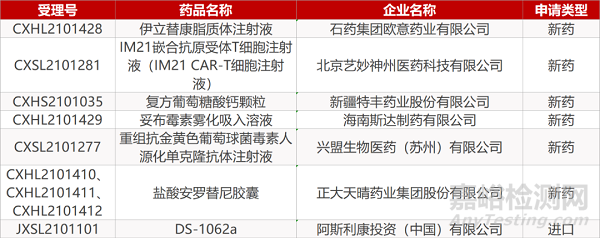
石药集团欧意的伊立替康脂质体注射液、北京艺妙神州医药的IM21嵌合抗原受体T细胞注射液(IM21 CAR-T细胞注射液)、海南斯达制药的妥布霉素雾化吸入溶液、兴盟生物的重组抗金黄色葡萄球菌毒素人源化单克隆抗体注射液、正大天晴的盐酸安罗替尼胶囊(3个规格)、阿斯利康的DS-1062a。
申请生产:
新疆特丰药业的复方葡萄糖酸钙颗粒。

来源:药研发


