您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-24 09:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
祐和医药CD40抗体国内报IND。百奥赛图旗下子公司祐和医药具有自主知识产权的YH003注射液的临床试验申请获CDE受理。YH003是一款CD40靶向的人源化IgG2激动型抗体,能够与CD40受体特异性结合,激活抗原提呈细胞,进而调控T细胞的抗肿瘤活性。临床前研究显示YH003对多种肿瘤均有良好的疗效,且安全性良好。YH003已在美国和澳洲开展Ⅱ期临床,此次为国内首报IND。
国内药讯
1.阿达木单抗预充针国内获批上市。信达生物阿达木单抗注射液(商品名:苏立信)预充针剂型获NMPA批准上市。苏立信是一款重组人抗TNF-α单抗,已于2020年9月首次获NMPA批准上市,目前已获批用于治疗类风湿关节炎、强直性脊椎炎、银屑病、多关节型幼年特发性关节炎、儿童斑块状银屑病、以及成年非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎。
2.首款双载体肺炎13价疫苗即将上市。康泰生物旗下子公司民海生物自主研发的双载体肺炎13价结合疫苗的NDA审评状态变更为“在审批”,预计即将获批上市。民海生物开创性地采用双载体蛋白与肺炎球菌荚膜多糖结合技术,旨在减少疫苗载体诱导的表位抑制作用,提高其免疫原性。该疫苗的接种年龄为6周龄-5岁儿童。目前国内已有辉瑞与沃森的两款13价肺炎疫苗获批上市。
3.武汉友芝友CD38/3双抗上I期临床。武汉友芝友生物CD38/CD3双抗在国内完成I期临床首例受试者给药。该试验由天津血液学研究所血液病医院的邱录贵教授与齐军元教授担任主要研究者,系一项多中心、开放、剂量递增的临床研究,旨在评估CD38/CD3双抗对复发或难治性多发性骨髓瘤的安全耐受性与药代/药效学特性。在临床前研究中,该双抗显示出起效剂量低、且不易产生耐药性等特点。
4.慧宝源新药赛洛嗪获FDA临床批件。慧宝源生物抗癌新药赛洛嗪(JP001)获FDA临床试验默示许可,即将在美国开展针对新诊断胶质母细胞瘤(GBM)的临床研究。这项研究旨在评估JP001联合标准放化疗治疗新确诊GBM患者的有效性及安全性。慧宝源生物计划先后在美国、中国台湾及中国大陆三地同步进行赛洛嗪的临床开发。
5.舒泰神STSA-1002国内报IND。舒泰神北京公司自主研发的STSA-1002注射液的临床试验申请获CDE受理。STSA-1002系一款靶向C5a的全人源单克隆抗体,能够与过敏毒素C5a特异性结合,从而阻断C5a诱导的中性粒细胞趋化与氧呼吸爆发,同时保留补体系统的溶菌功能。STSA-1002已获FDA批准针对重症新冠的临床试验申请,此次为国内首报IND。
国际药讯
1.辉瑞Xeljanz获欧盟批准两项新适应症。欧盟委员会(EC)批准辉瑞(Pfizer)口服JAK抑制剂Xeljanz(tofacitinib)用于治疗≥2岁、已使用过抗风湿药物治疗反应不佳的活动性多关节幼年特发性关节炎(JIA)和幼年型银屑病关节炎(PsA)患者。此次欧盟共批准Xeljanz两种配方,包括一种片剂和一种新的口服溶液。这是Xeljanz在欧盟获批的第五、第六项适应症。
2.口服CGRP拮抗剂预防偏头痛Ⅲ期临床积极。艾伯维CGRP抑制剂atogepant用于预防发作性偏头痛的Ⅲ期临床积极结果发表在《新英格兰医学杂志》上。与安慰剂相比,atogepant所有剂量组(10mg、30mg和60mg)12周后平均每月偏头痛天数显著减少(分别减少3.7、3.9和4.2天,vs2.5天,p<0.0001);而且该治疗组每月偏头痛天数减少>50%的患者比例也更高(分别有55.6%、58.7%和60.8%,vs29.0%,p<0.0001)。
3.创新FolRα-ADC获FDA快速通道资格。FDA授予Sutro公司FolRα靶向抗体偶联药物(ADC)STRO-002快速通道资格,用于治疗曾接受过1-3线系统性治疗的铂耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌。在一项I期临床STRO-002-GM1中,31例可评估上皮性卵巢癌患者中有10例符合应答标准。中位随访时间为8.4个月,中位无进展生存期(PFS)为7.2个月(95% CI: 4.5, 10.8)。安全性方面,最常见的3级和4级AEs为中性粒细胞减少(64%)。
4.癌症疫苗/Keytruda组合早期临床积极。Ultimovacs公司癌症疫苗UV1与PD-1疗法Keytruda联用,在一线治疗转移性恶性黑色素瘤的Ⅰ期临床第二个患者队列中(n=10)获得积极顶线结果。联合疗法的肿瘤杀伤疗效与第一个队列(n=20)相似。两个患者队列的1年后总生存率(OS)均较高且一致(队列2的OS为90%,队列1的OS为85%)。在第12个月时,两个队列均未达到中位无进展生存期(mPFS)。
5.Fate公司公布CAR-NK疗法新数据。Fate公司公布其诱导性多能干细胞(iPSC)改造NK细胞疗法FT516和CAR-NK疗法FT596的Ⅰ期临床最新结果。11例淋巴瘤患者使用不同剂量FT516有8例应答、其中6例为CR。14例使用FT596单方或与美罗华联用患者有10例应答,其中7例为CR。FT516和FT596耐受性良好,没有发生剂量限制性毒性、没有发生移植物抗宿主疾病。细胞因子风暴发生率较低、均为轻度。
6.新型早期肺癌血检临床结果积极。Delfi Diagnostics公司新型血液早筛技术在帮助提高早期肺癌检测的一项前瞻性研究“LUCAS”中获积极结果。结果表明,这项新型肺癌筛查技术,通过利用先进的机器学习算法分析无细胞DNA的基因组片段化图谱,能够在一组接受低剂量CT(LDCT)扫描的个体中,准确检测出大约90%的癌症病例,并将不必要的LDCT数目减少50%。相关结果发表在同行评议期刊Nature Communications上。
7.新型基因编辑技术SLEEK早期研究积极。由张锋教授联合创建的Editas Medicine日前公布了创新基因编辑技术SLEEK临床前的积极数据。在iPSC细胞中,SLEEK可提高转基因的敲入率(>95%)。在T细胞中,在敲除T细胞受体的同时可使用SLEEK高效敲入靶向CD19的嵌合抗原受体(CAR),产生的CAR-T细胞在体外检测中表现出强力抗癌活性。在NK细胞中SLEEK也具相似的转基因敲入率。SLEEK有望显著改良基于基因编辑的细胞疗法。
医药热点
1.黑龙江781个药品退出采购平台。黑龙江省医保局日前发布了《关于部分药品退出省采购平台的通知》。《通知》显示,此次退出黑龙江省采购平台的药品共有781个,包括小儿氨酚黄那敏颗粒、感冒康胶囊、心可舒胶囊、急支糖浆、头孢羟氨苄片等多种常用药。“生产成本增加,无法按现价供货”和“停产”是大部分药品退出的主要原因,还有250个药品明确以“成本上升”为由申请退出。
2.张文宏博士论文调查结果公布。复旦大学学术规范委员会依据2017年《复旦大学学术规范实施条例(试行)》的有关程序开展有关张文宏博士论文的调查核实工作,根据原上海医科大学1999年1月修订的《科研型博士研究生培养工作细则》,认定张文宏博士学位论文符合当年博士学位论文的要求,附录综述部分存在写作不规范,不影响博士学位论文的科研成果和学术水平,不构成学术不端或学术不当行为。
3.海南省级临床医学中心遴选结果揭晓。海南省公布省级临床医学中心和省级器官系统疾病中心的遴选结果,计划在“十四五”期间投入10个亿,扶持50个省级临床医学中心,拟提前布局和谋划“以器官系统疾病为中心”的诊疗模式。根据遴选结果,神经疾病中心由海南省人民医院和海南医学院第一附属医院同时筹建;心血管疾病中心由海南省人民医院和海南医学院第二附属医院同时筹建;肿瘤中心由海南医学院第一附属医院和三亚市人民医院同时筹建。
评审动态
申请临床:
江苏恒瑞的甲磺酸阿帕替尼片(3个规格)、上海德琪的ATG-008片(2个规格)、北京民海/深圳康泰的口服五价重配轮状病毒减毒活疫苗(Vero细胞)、苏州盛迪亚的SHR-1701注射液、三生国健的重组抗PD-1人源化单克隆抗体注射液、德琪的ATG-010片、勃林格殷格翰的BI655130注射液。
申请生产:
礼来的雷莫西尤单抗注射液(2个规格)。
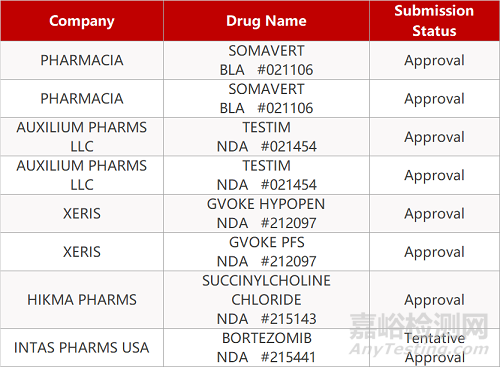
2. FDA新药获批情况(北美08月20日)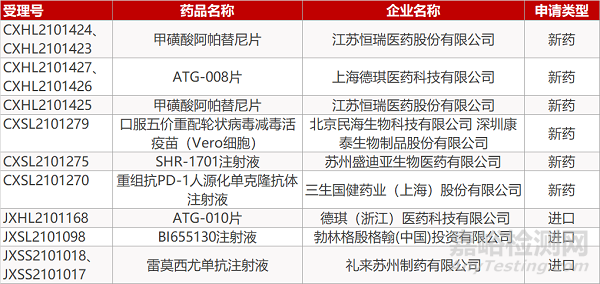

来源:药研发


