您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-08-05 14:01
国产第三类医疗器械首次注册审批流程
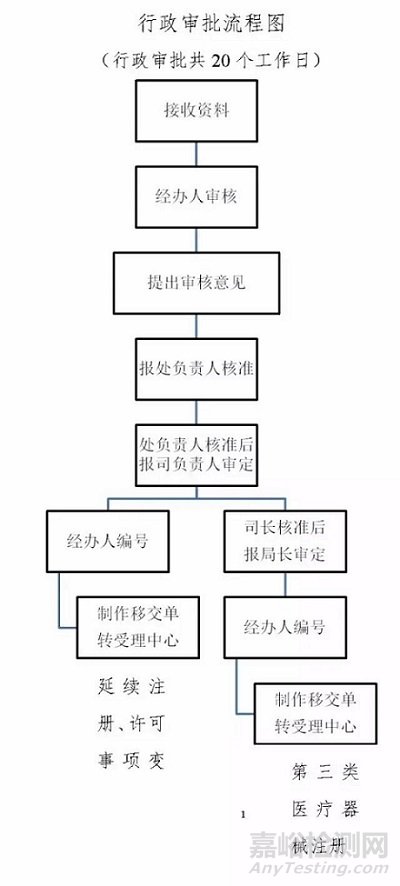
国产第三类医疗器械首次注册审批
一、适用范围
本指南适用于的申请和办理国产第三类医疗器械首次注册。
二、项目信息
(一)项目名称:国产医疗器械注册审批
(二)子项名称:国产第三类医疗器械首次注册审批
(三)审批类别:行政许可
(四)项目编码:30016
三、办理依据
《医疗器械监督管理条例》(国务院令第650号)第十一条:申请第三类医疗器械产品注册,注册申请人应当向国务院食品药品监督管理部门提交注册申请资料。
四、受理机构
国家食品药品监督管理总局医疗器械技术审评中心。
五、决定机构
国家食品药品监督管理总局。
六、审批数量
无数量限制
七、办事条件
申请人应为境内依法进行登记的企业。
八、申请材料
(一)申请材料清单
表一:医疗器械注册申报资料要求及说明
|
申报资料一级标题 |
申报资料二级标题 |
|
1.申请表 |
|
|
2.证明性文件 |
|
|
3.医疗器械安全有效基本要求清单 |
|
|
4.综述资料 |
4.1概述 |
|
5.研究资料 |
5.1产品性能研究 |
|
6.生产制造信息 |
6.1 无源产品/有源产品生产过程信息描述 |
|
7.临床评价资料 |
|
|
8.产品风险分析资料 |
|
|
9.产品技术要求 |
|
|
10.产品注册检验报告 |
10.1注册检验报告 |
|
11.说明书和标签样稿 |
11.1说明书 |
|
12.符合性声明 |
|
注册申报资料应有所提交资料目录,包括申报资料的一级和二级标题。每项二级标题对应的资料应单独编制页码。
表二:体外诊断试剂注册申报资料要求及说明
|
三类产品 |
|
|
1.申请表 |
∨ |
|
2.证明性文件 |
∨ |
|
3.综述资料 |
∨ |
|
4.主要原材料的研究资料 |
∨ |
|
5.主要生产工艺及反应体系的研究资料 |
∨ |
|
6.分析性能评估资料 |
∨ |
|
7.阳性判断值或参考区间确定资料 |
∨ |
|
8.稳定性研究资料 |
∨ |
|
9.生产及自检记录 |
∨ |
|
10.临床评价资料 |
∨ |
|
11.产品风险分析资料 |
∨ |
|
12.产品技术要求 |
∨ |
|
13.产品注册检验报告 |
∨ |
|
14.产品说明书 |
∨ |
|
15.标签样稿 |
∨ |
|
16.符合性声明 |
∨ |
注:申请人应当根据产品类别按照上表要求提交申报资料。
∨:必须提供的资料。
(二)申请材料提交
申请人可通过窗口报送、邮寄等方式提交材料。
九、申请接收
(一)接收方式
1.窗口接收;
2.邮寄接收。
接收部门:国家食品药品监督管理总局行政受理服务大厅
接收地址:北京市西城区宣武门西大街28号大成广场3门1层
邮政编码:100053联系电话:010—88331866.电子邮箱:slzx@126.com
(二)对外办公时间:上午:9:00—11:30 下午:13:00—16:00
十、办理基本流程
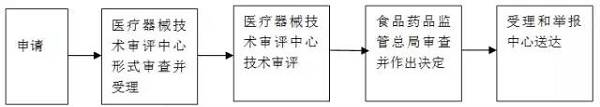
十一、办理方式
(一)国产第三类医疗器械注册申请
(二)国产第三类体外诊断试剂注册申请
1.受理:
申请人按照本《指南》第八条要求,向国家食品药品监督管理总局行政受理服务大厅提出申请,受理人员根据申报事项按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号)、《关于印发境内第三类和进口医疗器械注册审批操作规范》《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号)的要求对申报资料进行形式审查。
申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求的,予以受理;申报资料存在可以当场更正的错误的,允许申请人当场更正;申报资料不齐全或者不符合形式审查要求的,在5个工作日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申报资料之日起即为受理;申请事项不属于本部门职权范围的,即时告知申请人不予受理。
2.审查:
总局行政受理服务大厅自受理之日起3个工作日内将申报资料转交技术审评机构。
技术审评机构应当在90个工作日内完成第三类医疗器械注册的技术审评工作。
需要外聘专家审评、药械组合产品需与药品审评机构联合审评的,所需时间不计算在内,技术审评机构应当将所需时间书面告知申请人。质量管理体系核查的时间和申请人补充资料的时间,不计算在审评时限内。
3.许可决定:
国家食品药品监督管理总局应当在技术审评结束后20个工作日内作出决定,对符合安全、有效要求的,准予注册。对不予注册的,应当书面说明理由,并同时告知申请人享有申请复审和依法申请行政复议或者提起行政诉讼的权利。
4.送达:
自作出审批决定之日起10个工作日内,总局行政受理服务大厅将行政许可决定送达申请人。
十二、审批时限
1.受理:5个工作日;
2.行政许可决定:20个工作日(不含技术审评和申请人补充资料及补充资料审评所需的时间)。20个工作日内不能做出决定的,经总局领导批准,可延长10个工作日。
十三、审批收费依据及标准
(一)收费环节:受理
(二)收费项目:国产第三类医疗器械首次注册
(三)收费依据:国家发展改革委《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》(财税〔2015〕2号)和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》(发改价格〔2015〕1006号),《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号)。
(四)收费标准:15.36万元

来源:Internet


