您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-21 13:05
1、背景
随着杂质研究的要求越来越高,系统适用性溶液中杂质添加数量越来越多,无形中增加了企业的成本和制备的难度,故应制订相应的策略,在达到检测系统适用性要求的同时,降低企业的检测成本。
2、系统适用性要求
2.1分离度
2.1.1分离度要求是为了排除其它组分干扰待测物质的检测准确性,一般情况下,待测物质要与其它成份分离度达到1.5以上,才能判定为无干扰,要求严格的需要2.0以上才能符合要求。限于分离度计算方式的影响,待测物质和相邻其它组分峰高或者峰宽差异百倍甚至更多,造成分离度计算结果远远小于实际的分离效果,个别工作站有按峰谷比的方式计算,该种方式对峰宽差异大的组分有较好的结果,但不是所有的工作站均有该计算方式,故分离度要求可修订为基线分离更合理。
示例1:
在中国药典2020年版二部大多数头孢类中就有采用峰谷比作为系统分离度要求的情况,如头孢美唑钠中聚合物检测,截图如下

2.1.2应用情况
(1)含量测定目标和相邻组分需要制订分离度要求;
(2)有关物质测定主成分和相邻杂质需要制订分离度要求;
(3)有关物质中难分离的两个杂质且合并会超过限度的需要制订分离度要求;
2.2重复性
2.2.1重复性要求是考察仪器进样精密度,主要是排除仪器进样误差,对于含量测定,我们要求相对标准偏差不得过2.0%,当然这个数值也不是一成不变的,可根据中国药典2020年版四部9101指导原则(如下图)进行相应的调整,这里要说明下样品中待测定成分的含量问题,很多理解不一致,表中所说的应为绝对含量,而不是标示含量,应予以区分,以免订的标准过严,该指导原则主要是对常用的仪器如液相色谱仪制订,特殊的仪器可以根据实际情况进行适当的调整,如残留溶剂测定法中相对标准偏差规定外标法不得过10%,内标法不得过5%。
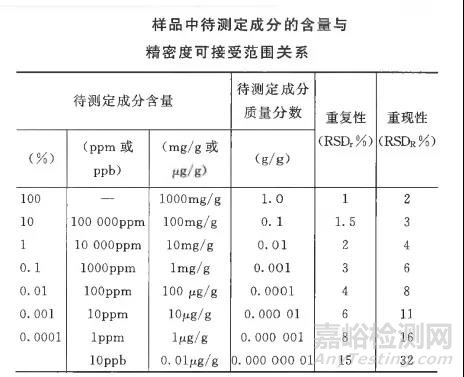
2.2.2应用情况
(1)精密度差的仪器,如气相色谱仪;
(2)进样量大或者进样量较小的方法;
(3)外标法建议考察;
2.3理论塔板数:分离效率
2.3.1理论塔板数是直接反应色谱柱柱效,是分离效率的一种参数,理论塔板数的高低主要是看保留时间和峰宽的比值关系,峰越宽,理论塔板数越低,造成峰高和分离度越差。
2.3.2应用情况
(1)在一定程度上可以替代分离度要求,如干扰组分不易获得,在理论塔板数比较高的情况下不影响分离度,可以考虑用理论塔板数作为系统适用性要求而不是分离度指标;
(2)如采用峰高计算结果,则应要规定理论塔板数;
2.4拖尾因子
2.4.1拖尾因子主要是反映峰对称情况,有时也叫对称因子,峰形拖尾或者前沿,会影响到积分边际线的位置,使得峰高或者峰面积改变,对定量检测的准确性产生影响,即使是定性,也会影响到灵敏度的判断,故一般情况下会规定以峰高作为定量参数的规定拖尾因子应在0.95~1.05范围内,是以峰面积作为定量参数,则规定0.8~1.2范围内,当然也可以根据实际情况适当放宽,如限度范围比较宽的,积分边际线稍微调整影响不大的情况下可放宽标准。
2.4.2应用情况
(1)峰高作为定量参数时应制订要求;
(2)峰面积作为定量参数,且积分边际线影响到定量结果的时候应制订要求;
2.5灵敏度
2.5.1灵敏度是考察系统对含量较小的成分的检测能力,一般情况下定量检测规定灵敏度溶液信噪比不小于10,定性检测信噪比不小于3。
2.5.2应用情况
(1)灵敏度差的检测系统应制订灵敏度要求;
(2)制订忽略限的检测方法也应考察灵敏度;
2.6线性
2.6.1在定量过程中,待测物和参照物浓度不可能是同一个值,或多或少会有差异,当差异大时,误差可能会很大。线性是定量的基础,方法验证时,线性范围应尽可能考虑待测物质的检出浓度,使得检出浓度在线性范围内,否则定量结果很难保证准确性。当有效成分测定时,一般规定相关系数应大于0.999,在安全性和有效性能有效保障的情况下可放宽至0.99。
2.6.2应用情况
(1)标准曲线法:当待测物浓度不明确时,应采用考察线性,特别是线性受环境等条件影响较大时;
(2)当基质干扰较大时,也就是方法验证时线性截距占比较大,这种情况下不适合采用一点法进行定量,应采用标准加入法进行测定。
2.7重现性
2.7.1这里说的重现性不是方法验证里的重现性,是参照物平行配制的情况,如对照品溶液配制第二份,测得的量相对于第一份的回收率,确认配制的结果准确性,一般情况下规定回收率范围为98%~102%,也可以根据中国药典2020年版四部9101指导原则(如下图)进行相应的调整。
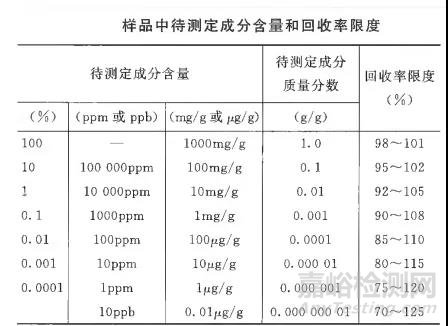
2.7.2应用情况
定量参照物配制耐用性差的应制订该要求,如称量或移取量比较少,误差比较大。
3、系统适用性制订
3.1方法开发阶段
3.1.1有关物质
对于有关物质来讲,不管是定量检测还是定性检测,分离度指标至关重要,所以有关物质系统适用性的分离度指标无可避免;理论塔板数和拖尾因子也只是侧面提高分离度的,所以在考虑分离度的情况下可不用考察该指标;而有关物质一般情况下含量比较低,准确度可允许的偏差比有效成分要求较低,故重复性和重现性就不是很关键;杂质定量检测时,线性在方法验证阶段证明即可,无需订入系统适用性要求,定性检测则不用考察线性;但是由于有关物质含量比较低,检测能力就显得很重要,故灵敏度是在考虑的范围内。
(1)在有关物质方法开发阶段,专属性至关重要,杂质谱分析应全面,尽可能的得到工艺杂质和降解杂质,对已知杂质进行定性,配制混合溶液进行方法开发,要求杂质和主成分应能有效分离,杂质之间也尽可能的分离,所有杂质应能检出,不能检出的应有相应的补充方法。
(2)对主成分进行强制降解实验,主成分也应能和降解杂质有效分离,降解杂质和已知杂质之间也应尽可能分离。
(3)对主成分和已知杂质的检出能力进行确认,确保方法初步可行。
(4)应对方法的耐用性进行初步的考察,确保方法在微小变动的情况下能满足要求。
示例2:
某品种根据杂质谱分析,将生产工艺过程中可能产生的杂质按限度浓度的十倍配制已知成分混合溶液,开发和优化方法并考察耐用性,结果如下:
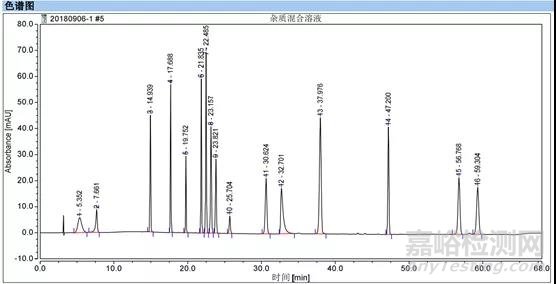
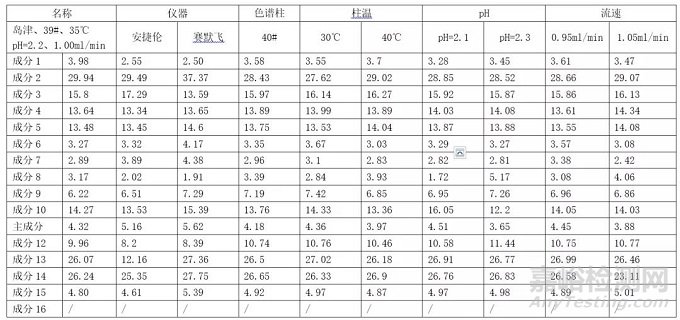
3.1.2含量
对于含量测定来讲,杂质相互之间的分离情况可以不用考虑,但杂质和有效成分的分离度至关重要,如果分离度达不到要求,可能会影响到有效成分测定的准确度,另外一种情况也需要考虑,方法能把所有杂质洗脱出来,以免影响下一针的检验;理论塔板数和拖尾因子对含量测定也有一定的影响,虽然现在基本采用的是峰面积计算含量,但这两个参数影响到了积分边际线的位置,使得峰面积有所改变;灵敏度对含量测定影响不大,所以药典不对灵敏度进行要求,但有些微量测定还是需要制订灵敏度,如清洁验证、中药有效成分等;在采用一点法测定含量的情况下,线性不作为考察的重点,但含量不明确或者波动比较大的情况下需要考察,甚至采用标准曲线法测定含量;含量测定直接影响有效性,准确度要求较高,故重复性和重现性均要考察。
(1)应确保所有的杂质均能和有效成分分离开,制订分离度要求,强制降解纯度阈值符合要求,所有杂质均能有效系统;
(2)方法应有相应重复性,甚至重现性,一般情况下,参照物质采用5+2或者6+1的方式进行考察;
(3)采用峰面积计算结果的,理论塔板数和拖尾因子可以适当放宽,但也不能太低,具体可以经过研究后结合产品特性进行规定;
(4)应对方法的耐用性进行初步的验证,确保测定条件微小变动系统也能耐用;
3.2方法验证阶段
3.2.1有关物质
有关物质方法验证,应对根据杂质谱分析对很大概率产生的杂质进行研究,而不是所有的已知杂质都要进行方法验证,否则会增加方法验证的难度,增加不必要的时间和经济成本;
(1)对于接近限度的杂质,分离度应达到要求,否则需要重新优化方法再进行验证。
(2)主成分和相邻杂质的分离度要求不可避免,应要验证;
(3)对检出的工艺杂质和降解杂质应要验证;
(4)对多批次未检出,且检出可能性较小的做简单验证。
3.2.2含量
经过了一定的数据积累,对含量测定的方法有了深入的了解,一些不影响的系统适用性要求可以考虑不再进行考察,有些需要特别关注。
(1)如果相邻杂质和有效成分分离度很有保证,不管耐用性条件如何变动,分离度均能达到要求,可以不考虑制订分离度要求;
(2)相邻杂质和有效成分分离度不一定能保证,需要制订,如果相邻杂质不易的或者经济考虑,可以顺延采用就近的杂质进行规定,规定的要求要能保证相邻杂质和有效成分的分离;
(3)方法验证阶段,需要对其它杂质的检出和对有效测定结果的影响情况予以考虑,如果对结果影响较小,则不用考虑该杂质的洗脱,缩短分析时间。
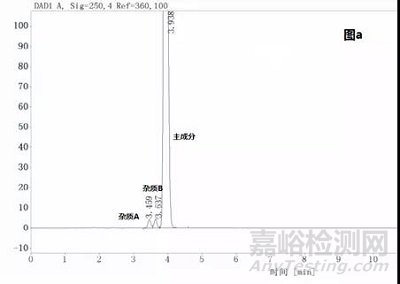
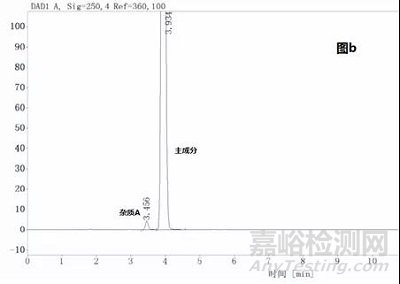
示例3:
某品种含量方法开发时,杂质B和主成分比较近,分离度为1.8(图a),但杂质B不容易得到,如果将杂质B和主成分的分离度作为系统适用性要求,则后期研究或检验的时候势必造成一定的困扰,但顺延采用就近的较易得的杂质作为系统分离度要求(如图a中的杂质A),就可以避免后期的麻烦,当然分离度也得相应的做调整,在该系统下杂质A和主成分的分离度为2.8(图b),在此情况下杂质B和主成分的分离度则必大于1.5,则制订杂质A和主成分的分离度不小于2.8,再对方法的进行稍微的调整,使得杂质A和主成分的分离度保证大于2.8,满足耐用性要求。
3.3质量标
准制订阶段
3.3.1有关物质
经过方法验证和多批次的生产检验,对本品的工艺和降解杂质检测情况已经有了基本的数据积累,这时可以根据实验目的对系统适用性的要求就可以相应的进行简化;
(1)和主峰相近的杂质应添加至系统适用性溶液中考察分离度;
(2)接近限度的杂质应添加至系统适用性溶液中考察和相邻成分的分离度;
(3)能检测出的杂质应添加至系统适用性溶液中进行定性;
(4)大概率会降解产生的杂质应添加至系统适用性溶液中进行定性;
(5)质量标准中应附典型的系统适用性图谱(可以考虑附方法开发时全杂质的典型图谱);
(6)对系统适用性溶液稳定性进行考察,考察指标可以规定为各成分含量应为初始条件的70%~130%。
3.3.2含量测定
经过了方法验证和多批次的生产检验,有了大量数据的积累,系统适用性的要求可以根据经验进行进一步的优化。
(1)如果相邻杂质和有效成分分离度难保证,但基本未检出,对结果准确度影响微乎其微,也不会降解产生,则可不用考虑该杂质和有效成分的分离度;
(2)定量限浓度远远小于检测浓度,可不考虑灵敏度要求;
(3)理论塔板数和拖尾因子不会影响积分边际线或者影响很小,可以忽略不计,则可不考虑;
(4)采用一点法测定含量的可不用考察线性;
(5)重复性和重现性应要考察。
4、总结
4.1影响测定准确性的指标必须要考察,对准确度影响很小的可不用考察;
4.2耐用性差的指标必须要考察,耐用性好的可不用考察;
4.3法规规定的指标必须考察,法规没有规定的可不用考察。
5、参考文献
5.1中国药典2020年版;
5.2GMP指南2010年版;
5.3中国药品检验标准操作规范2019年版;
5.4ICH指导原则;

来源:药事纵横


