您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-30 22:18
人工复苏器适用于人工复苏器,该产品用于实施人工呼吸、急救时提供肺通气。
一、人工复苏器的结构与作用机理
1.人工复苏器的结构和组成
人工复苏器通常由病人阀(可含限压阀)、呼吸球囊、进气阀组组成。可根据不同的使用要求配置各种相应的选配件,如面罩、氧气管、储气袋或储气管等。按照使用次数可以分为可重复使用、一次性使用产品。产品结构示意图如下:
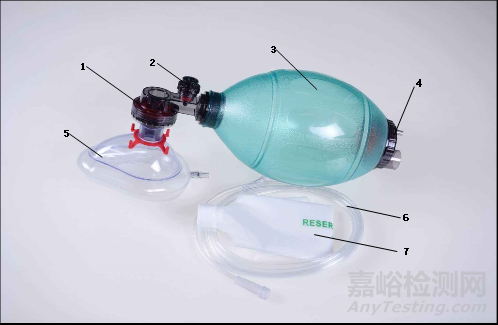
1-病人阀 ; 2-限压阀; 3-呼吸球囊; 4-进气阀组;
5-面罩(选配); 6-氧气管(选配); 7-储气袋(选配)
图1. 人工复苏器示意图
2.人工复苏器的工作原理/作用机理
人工复苏器产品主要用于实施人工呼吸、急救时提供肺通气。使用时,按压呼吸球囊,进气阀组关闭,气体经病人阀端进入患者呼吸道;释放呼吸球囊,病人阀关闭,在压力差作用下,外界空气经进气阀组进入球囊。当需要高浓度氧气输送时,复苏器连接氧气管、储气袋或储气管使用,通过氧气管接头连接氧气源,储气袋充满氧气后,过量氧气通过进气阀组排出到空气中。
二、人工复苏器的研发实验要求
1.性能研究
应详述产品技术要求中主要性能指标及检验方法的确定依据,出具采用的原因及理论基础,给出涉及的研究性资料、文献资料和标准文本。如适用的国家标准、行业标准中有不采纳的条款,应将不采纳的条款及其理由予以阐明。
应研究的产品基本性能至少包括进气阀接头、拆卸与装配、被呕吐物污染的患者阀功能、机械冲击、增补氧和输送的氧浓度、呼气阻抗、吸气阻抗、死腔、最小输送容量、压力限制、微生物限度等。
说明书中描述的性能或产品宣称的特殊性能应进行研究。
若产品带有配合使用的配件,应分别列出附件的材料、结构、性能要求。
应给出产品的主要原材料选择依据等信息。
2.生物相容性的评价研究
应描述人工复苏器产品与人体接触部件的材料,以及在使用过程中与皮肤组织接触的性质和时间,参照《关于印发医疗器械生物学评价和审评指南的通知》(国食药监械〔2007〕345号)、GB/T 16886.1—2011的要求对其进行生物相容性评价。
建议参照ISO 18562-1-2017,对与人体间接接触的部件进行生物相容性评价研究。
3.消毒或灭菌工艺研究
应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并给出灭菌确认报告。若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并给出研究资料。可根据适用情况,按照GB 18280.1-2015、GB18280.2-2015、 GB 18279.1-2015、GB/T 18279.2-2015等标准的要求开展研究。
对于重复使用的产品,应出具终端用户灭菌或消毒方面的研究资料,包括重复灭菌或消毒次数、产品性能的研究。
对于使用前需要进行清洗、消毒或灭菌的,应当明确推荐的消毒或灭菌工艺(方法和参数)以及所推荐消毒/灭菌方法确定的依据。
4.产品有效期和包装研究
(1)产品有效期和包装研究情况可通过实时老化或加速老化试验获得。有效期研究项目包含包装完整性和技术要求中规定的项目,建议选择原材料最多,组件最完整,使用性能可以覆盖使用单元的型号进行验证。加速老化试验可参照YY/T 0681.1—2009《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》系列标准、GB/T 19633.1—2015《最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求》、GB/T 19633.2—2015《最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求》、YY/T 0698.1—2011《最终灭菌医疗器械包装材料 第1部分:吸塑包装共挤塑料膜要求和试验方法》系列标准等进行;非无菌供应的产品可参考上述标准进行有效期研究。
(2)应出具包装研究资料,依据有关国内、国际标准(如GB/T 19633.1-2015、GB/T 19633.2-2015、ISO 11607-1等)对包装进行分析研究和评价。直接接触产品的包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能给出的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适应性;非无菌供应的产品,可参考上述适用的项目进行包装研究。
5.主要性能指标
人工复苏器产品有直接对应的行业标准YY 0600.4-2013《医用呼吸机 基本安全和主要性能专用要求 第4部分:人工复苏器》,对产品本身明确了要求。
物理性能:
1.患者连接口接头
2.呼吸气体的呼气口接头
3.面罩接头
4.气囊充气阀接头
5.气囊进气阀接头
6.螺纹气体过滤器接头
7.氧气管接头和压力计接头
8.操作要求
8.1 拆卸和装配
8.2被呕吐物污染后的患者阀功能
9.机械冲击
9.1坠落试验
9.2浸水
9.3气囊充气阀
10.增补氧和输送的氧浓度
11.呼气阻抗
12.吸气阻抗
13.患者阀故障
14.患者阀泄漏—前向泄漏
15.人工复苏器死腔和重复呼吸
16.通气性能
16.1最小输送容量
16.2压力限制
17.储存和操作条件
18.压力限制系统设置的指示。
19.外观要求。
20.若产品包含其他配合使用的附件,应结合产品功能、结构制定相关性能要求。例如,储气袋性能要求(接头、容量、外观、气密性)。
22.1化学性能:
根据不同材料特性,跟人体直接接触的部件,应补充化学性能的要求(至少pH值、重金属)。
22.2生物性能:
非无菌供应的产品,若产品首次使用前不需要进行清洗、消毒、灭菌处理,对微生物限度进行规定。
22.2以灭菌包装提供的产品应无菌。
22.3采用环氧乙烷灭菌的产品,环氧乙烷残留量不得大于10μg/g。
三、相关标准
表1. 产品适用标准(统一格式,标准编号)
|
标准编号 |
标准名称 |
|
GB/T 191—2008 |
包装储运图示标志 |
|
GB 18280.1-2015 |
医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求 |
|
GB 18280.2-2015 |
医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量 |
|
GB/T 18280.3—2015 |
医疗保健产品灭菌 辐射 第3部分:剂量测量指南 |
|
GB 18279.1-2015 |
医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求 |
|
GB/T 18279.2-2015 |
医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南 |
|
GB/T 19633.1-2015 |
最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求 |
|
GB/T 19633.2-2015 |
最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求 |
|
GB/T 14233.1—2008 |
医用输液、输血、注射器具检验方法第1部分:化学分析方法 |
|
GB/T 14233.2-2005 |
医用输液、输血、注射器具检验方法第2部分:生物学试验方法 |
|
GB/T 16886.1—2011 |
医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5—2017 |
医疗器械生物学评价 第5部分:体外细胞毒性试验 |
|
GB/T 16886.7-2015 |
医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量 |
|
GB/T 16886.10—2017 |
医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
|
GB/T 16886.12-2017 |
医疗器械生物学评价 第12部分:样品制备与参照样品 |
|
YY/T 0287—2017 |
医疗器械质量管理体系用于法规的要求 |
|
YY/T 0313—2014 |
医用高分子产品包装和制造商提供信息的要求 |
|
YY/T 0316—2016 |
医疗器械风险管理对医疗器械的应用 |
|
YY/T 0466.1—2016 |
医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
|
YY/T 1474—2016 |
医疗器械可用性工程对医疗器械的应用 |
|
YY 0600.4-2013 |
医用呼吸机 基本安全和主要性能专用要求 第4部分:人工复苏器 |
|
YY/T 1040.1-2015 |
麻醉和呼吸设备 圆锥接头 第1部分:锥头与锥套 |
|
GB/T 1962.1-2015 |
注射器、注射针及其他医疗器械用6%(鲁尔)圆锥接头 第1部分:通用要求 |
|
ISO 18562-1:2017 |
Biocompatibility evaluation of breathing gas pathways in healthcare applications -- Part 1: Evaluation and testing within a risk management process |
|
/ |
中华人民共和国药典(2015版) |
四、相关风险
产品的风险管理报告应符合YY/T 0316-2016《医疗器械风险管理对医疗器械的应用》的有关要求。
表2. 产品主要初始危险因素
|
通用类别 |
初始事件和环境示例 |
|
不完整的要求 |
性能要求不符合。 与人体直接接触部件材料的生物相容性问题。 说明书未对人工复苏器的使用操作方法进行准确的描述与说明。 货架有效期不恰当规范:在标识的有效期前,已无法保证产品的性能要求。 |
|
制造过程 |
制造过程的控制不充分:生产过程关键工序控制点未进行监测,导致人工复苏器不合格。 供方的控制不充分:外购、外协件供方选择不当,外购、外协件未进行有效进货检验,导致不合格外购、外协件投入生产。
|
|
运输和贮藏 |
不恰当的包装:产品防护不当导致产品运输过程中损坏。 不适当的环境条件:产品存放于极端恶劣的环境条件中,如不干净的仓库,长时间高温/低温、高湿的环境,造成产品受到污染。 |
|
清洁、消毒和 灭菌 |
消毒执行不恰当:未对产品消毒工艺进行确认或未按照确认过的参数进行消毒,导致消毒不彻底,产品有污染。 灭菌执行不恰当:未按要求对人工复苏器进行灭菌,或未达到灭菌效果。 重复使用次数超过经验证的次数。 |
|
处置和废弃 |
没提供信息或提供信息不充分:未在使用说明书中对产品处置和废弃方法进行说明,或信息不充分 |
|
材料 |
生物相容性:与人体接触的工具部分或其他部件选择不当可致过敏等反应。 阀门老化,密封性能问题 |
|
人为因素 |
易混淆的或缺少使用说明书:如缺少详细的使用方法、缺少必要的警告说明;使用不适当的型号;操作说明过于复杂,不易懂。 由缺乏技术的/未经培训的人员使用:使用者/操作者未经培训或培训不足,不能正确使用人工复苏器。 |
表3. 部分危险、可预见的事件序列、危险情况和可发生的伤害之间的关系
|
危险 |
可预见的事件序列 |
危险情况 |
伤害 |
|
化学的 |
生产过程使用了加工助剂,注塑过程使用了工业脱模剂等,产品清洁不完全。
|
带有化学残留的产品使用于人体。
|
刺激患者中毒,引起炎症,伤害人体健康。 |
|
生物学的 (微生物污染) |
消毒或灭菌效果不佳;初始污染菌超标。 |
有微生物污染的器械使用于人体 |
交叉使用,感染患者,进而感染与患者接触的人员 |
|
生物相容性 |
产品无良好的生物相容性; |
与人体组织不相容的器械使用于人体 |
中毒、刺激、过敏等症状,伤害患者健康,严重时危及患者生命。 |
|
功能 |
进气阀漏气,无法提供足够的输送容量;病人阀阻塞,气体无法正常输送至患者口中;一次性使用的产品被重复使用。 |
无法提供有效的肺通气;未进行消毒灭菌或消毒灭菌后产品性能无法满足性能要求。 |
错失最佳 呼吸抢救时间;交叉感染或无法提供有效肺通气。 |

来源:嘉峪检测网


