您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-23 11:32
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.信达FGFR抑制剂在台湾获批。信达生物小分子新药达伯坦®(pemigatinib)在台湾获批用于治疗经治、肿瘤FGFR2融合或重排、不可手术切除的局部晚期或转移性胆管癌成人患者。Pemigatinib(Pemazyre®)是Incyte公司开发的一种针对FGFR亚型1/2/3的强效选择性口服抑制剂,于去年4月获FDA批准用于上述适应症。在一项 II期临床FIGHT202 中,pemigatinib在这类患者中的ORR达到35.5% (95%CI: 27%, 45%),中位DOR为9.1个月。
2.恒瑞「氟唑帕利」新适应症即将获批。恒瑞医药PARP抑制剂氟唑帕利胶囊的新适应症上市申请(CXHS2000046)进入「在审批」阶段,预计即将获批,用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌在含铂化疗达到完全缓解或部分缓解后的维持治疗。氟唑帕利是首个获批的国产PARP抑制剂。去年12月,NMPA批准氟唑帕利上市,用于治疗既往经过二线及以上化疗的伴有BRCA1/2致病性或疑似致病性突变的复发性卵巢癌患者。
3.科伦HER2 ADC将上关键II期临床。科伦药业宣布,控股子公司科伦博泰已就HER2 ADC药物(A166)治疗HER2阳性乳腺癌以单臂试验支持附条件批准上市的关键II期试验与CDE达成一致意见,即将按照CDE回复意见,快速组织实施A166关键II期临床试验。在I期临床中,A166抗体与毒素分子在血液中结合稳定,整体耐受性、安全性良好,并在经过多线抗HER2治疗后的HER2阳性乳腺癌患者中显示出良好的抗肿瘤活性。
4.治疗“渐冻人症”新药在美获批临床。喜鹊医药1类新药硝酮嗪治疗肌萎缩侧索硬化症 (ALS)获FDA临床试验默示许可,即将在美国开展Ⅰ期临床桥接试验。硝酮嗪具有独特的作用机理,能高效清除自由基,保护线粒体功能,增加ATP产生,促进细胞自噬,恢复细胞活力。在中国,该新药正在开展治疗ALS的Ⅱ期临床,以及用于治疗急性缺血性脑卒中、糖尿病肾病的Ⅱ期临床。
5.BI治疗精神分裂症新药拟纳入突破性疗法。勃林格殷格翰口服新型GlyT1抑制剂BI 425809获CDE拟纳入突破性疗法认定,适应症为治疗精神分裂症成人患者的认知障碍。值得一提的是,该产品已于今年5月获FDA授予的突破性疗法资格认定。在一项II期研究(NCT02832037)中,分析结果显示BI 425809 10mg和25mg剂量组的MCCB总体复合T评分与基线的变化值较安慰剂组差异最大(调整后的平均差异:10mg:1.98,25mg:1.73)。BI 425809和安慰剂不良反应发生率相当。
6.治疗宫颈癌药械组合临床新进展。亚虹医药用于非手术治疗宫颈高级别鳞状上皮内病变(HSIL)的光动力药械组合产品APL-1702(Cevira®)国际多中心III期临床 (APRICITY) 在欧洲完成首例患者给药。APL-1702是Photocure公司开发的一个集给药和光动力学治疗为一体的装置。在中国,APL-1702已于去年7月获CDE批准,开展国际多中心III期临床,首例患者去年11月已在中国完成入组。
国际药讯
1.恩格列净获欧盟批准治疗心力衰竭。勃林格殷格翰与礼来联合开发的SGLT2抑制剂恩格列净片(empagliflozin,Jardiance)获欧盟委员会批准扩展适应症,用于治疗射血分数降低型慢性心力衰竭患者(患有或不患有2型糖尿病)。在一项Ⅲ期试验EMPEROR-Reduced中,与安慰剂相比,该药使此类患者因心血管死亡或住院的综合相对风险降低25%。在中国,empagliflozin去年底已提交了注册申请,用于治疗伴或不伴糖尿病、射血分数降低型心力衰竭成人患者。
2.诺华Cosentyx获英国批准治疗nr-axSpA。英国国家健康和保健研究所(NICE)推荐诺华IL-17A单抗Cosentyx(secukinumab),作为治疗活性非放射学中轴型脊柱关节炎(nr-axSpA)的一种选择,用于治疗成人非甾体抗炎药 (NSAID) 不能很好控制的客观炎症迹象。研究数据显示,与安慰剂相比,Cosentyx治疗显著缓解患者疾病症状(40.8%vs28%);显著改善患者包括疼痛、疲劳,以及与健康相关的生活质量。
3.施维雅IDH1/2抑制剂早期临床积极。施维雅IDH1/IDH2双重抑制剂vorasidenib治疗IDH突变晚期实体瘤(包括低级别胶质瘤,LGG)的Ⅰ期临床(NCT02481154)结果发表于《Clinical Cancer Research》上。研究数据显示,vorasidenib在每日一次剂量<100mg时表现出良好的安全性;在无强化低级别胶质瘤患者中,客观缓解率(ORR)为18%;中位无进展生存期(PFS)为36.8个月(3.1年)[95%可信区间(CI):11.2-40.8个月]。
4.真实数据显示瑞德西韦降低住院患者死亡率。吉利德宣布,对大型真实世界数据集的三项回顾分析(Aetion和HealthVerity分析、Premier分析、SIMPLE-Severe分析)显示,该公司抗病毒疗法Veklury(remdesivir,瑞德西韦)与降低住院患者的死亡率相关。其中,在针对24856例接受Veklury治疗的COVID-19住院患者的医疗数据分析显示,与对照组相比,Veklury将患者的死亡风险降低23%(HR=0.77,95% CI:0.73-0.81);并显著提高治疗患者28天时的出院率(HR=1.19,95% CI:1.14-1.25)。
5.罗氏治疗AD抗体能够降低生物标志物。罗氏拟用于治疗阿尔茨海默病(AD)的抗β-淀粉样蛋白抗体gantenerumab在一项Ⅱ/Ⅲ期研究中获最新分析数据。在显性遗传AD的患者中,该新药可降低大脑中疾病和神经退行性疾病的生物标志物;患者表现出大脑中淀粉样蛋白斑块的减少和蛋白质tau的含量降低。华盛顿大学已把详细数据发表在《自然医学》杂志上。目前华盛顿大学已启动了扩展研究。
6.Immutep拟扩展LAG-3创新疗法临床开发。Immutep公司完成6000万澳元(约4500万美元)的融资,用于扩展其可溶性LAG-3融合蛋白eftilagimod alpha(efti)的临床开发项目。efti是该公司的主打在研疗法,在与PD-1抑制剂Keytruda联用,一线治疗非小细胞肺癌患者时,达到47%的总缓解率。Immutep计划启动新的注册性Ⅲ期临床,评估efti治疗转移性乳腺癌患者的效果;启动新的Ⅱ期临床评估efti和PD-1疗法以及化疗联合用药的效果等。
医药热点
1.美国5500万剂新冠疫苗全球分配计划。美国白宫21日公布5500万剂新冠疫苗全球分配计划。美国将通过世卫组织主导的“新冠肺炎疫苗实施计划”分享这批疫苗中的约4100万剂,其中约1400万剂将提供给拉丁美洲和加勒比地区,约1600万剂将提供给亚洲地区,约1000万剂将提供给非洲地区。其余约1400万剂将直接提供给阿富汗、伊拉克、约旦河西岸和加沙地带等国家和地区。
2.2021中国医院床位规模100强榜出炉。根据医院规模化发展状况,《看医界》传媒日前推出“中国医院床位规模排行榜”。榜单显示,床位规模排名前十的医院分别为郑大一附院(8500)、中国医科大附属盛京医院(6750)、哈尔滨医科大附一院(6496)、南昌大学附一院(6100)、哈尔滨医科大附二院(6012)、华中科大同济医学院附属同济医院(6000)、吉林大学附一院(5900)、青岛大学医学院附属医院(5687)、安徽省立医院(5450)、湖北省人民医院(5200)。
审评动向
申请生产:
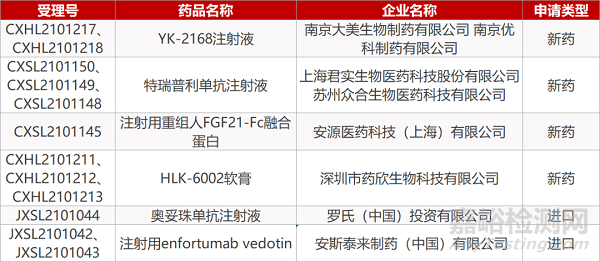
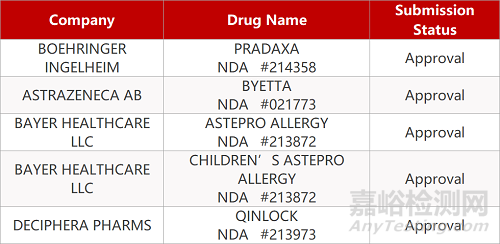

来源:药研发


