您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-09 09:01
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
本文共:16条资讯,阅读时长约:3分钟 」
今日头条
荣昌生物ADC品种即将获批上市。荣昌生物自主研发的抗体偶联(ADC)药物「注射用纬迪西妥单抗」(RC48,爱地希)上市申请进入「在审批」阶段,有望即将获批上市,成为首个国产ADC新药。在一项用于治疗HER2过表达、局部晚期或转移性胃癌的II期临床中,最新数据显示IRC评估的客观缓解率(ORR)为24.4%,中位无进展生存期(PFS)为4.1 个月,中位总生存期(OS)为7.9个月。
国内药讯
1.科兴新冠疫苗紧急使用范围扩至3岁以上。NMPA日前已批准科兴新冠疫苗紧急使用年龄范围扩大至3岁以上,国家卫健委将组织有关专家,根据疫情防控需要由高年龄组向低年龄组梯次推动接种。现阶段,国内已有4个新冠疫苗获批附条件上市,3个疫苗获批紧急使用,8个疫苗在国外获批Ⅲ期临床试验,1个mRNA疫苗在国外获伦理批准,共有21个新冠疫苗进入临床试验阶段。
2.和记黄埔索凡替尼新适应症即将获批。和记黄埔1类新药「索凡替尼」新适应症上市申请(CXHS2000028)进入「在审批」阶段,预计即将获批,用于治疗晚期胰腺神经内分泌瘤。索凡替尼(HMPL-012)是一款具有抗肿瘤血管生成与免疫调节双重作用的新型激酶抑制剂,去年12月,索凡替尼已获批上市,用于晚期分化良好的非胰腺来源的神经内分泌瘤。
3.百济神州PD-1抗体申报新适应症。NMPA受理百济神州PD-1抗体百泽安(替雷利珠单抗注射液)用于治疗既往经治、局部晚期不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤患者的上市申请。这也是替雷利珠单抗提交的第七项适应症上市申请。在国内,百泽安已获批用于治疗晚期鳞状非小细胞肺癌(NSCLC)、复发或难治性经典型霍奇金淋巴瘤(cHL)以及局部晚期或转移性尿路上皮癌(UC)三项适应症。
4.肺干细胞新药治疗COPD获批临床。吉美瑞生旗下公司仙荷医学开发的REGEND001细胞自体回输制剂获国家药监局临床试验默示许可,拟开发用于治疗肺弥散功能障碍的慢性阻塞性肺病(COPD)。REGEND001是该集团自主研发的一款全球首创(First-in-Class)干细胞新药,属细胞治疗产品。该产品去年7月已获批开展用于早、中期特发性肺纤维化(IPF)的临床研究。
5.福沃药业EGFR靶向新药国内获批临床。福沃药业第四代EGFR小分子抑制剂FWD1509获国家药监局临床试验默示许可,临床应症为晚期非小细胞肺癌(NSCLC)。在多项临床前研究中,FWD1509可有效抑制EGFR exon 20插入突变多种亚型的肺癌细胞的增殖,显示出良好的抗肿瘤疗效;而且对HER2 exon 20插入突变的疗效同样显著。此外,FWD1509能高效地透过血脑屏障,有望用于治疗各类EGFR突变型NSCLC的脑转移。
6.征祥医药募资推进抗肿瘤新药全球临床试验。南京征祥医药宣布完成2亿元人民币的A+轮融资,本轮投资由国投招商领投,经纬中国以及醴泽资本跟投。本轮募资将用于加速推进该公司新一代抗肿瘤药物ZX-101A的全球多中心临床试验,同时完成抗流感新药ZX-7101A和高选择性PI3Kγ抑制剂ZX-4081等临床申报。征祥医药计划于今年第三季度完成2项中国及1项美国的IND申报。
国际药讯
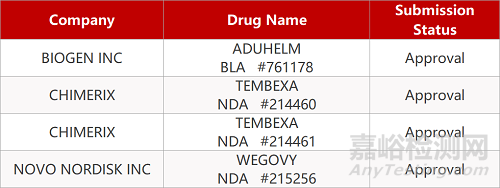
1.渤健治疗AD新药获FDA批准上市。FDA加速批准渤健Aβ抗体Aduhelm(aducanumab)上市,用于治疗阿尔茨海默病(AD),这是自2003年以来,FDA批准的首款AD新药。此次加速批准是基于aducanumab对替代终点的影响,在Ⅲ期临床中它一致地降低患者大脑中淀粉样蛋白斑块的水平。据悉,Aducanumab起始剂量有个爬坡过程,稳定后给药剂量为10mg/kg,注射给药需要1小时,定价为每次注射4312美元(74kg平均体重),每年治疗成本为5.6万美元。
2.天花抗病毒新药获FDA批准上市。Chimerix公司抗病毒药物Tembexa(brincidofovir)片剂和口服混悬剂获FDA批准上市,用于治疗天花(smallpox)成人和儿科患者。Tembexa也是首个获批用于所有年龄组的天花抗病毒药物,包括新生儿。FDA批准Tembexa,是基于人类天花疾病的2种致死性正痘病毒动物模型的疗效数据,在兔痘模型和鼠痘模型的关键研究中,在动物感染致死病毒剂量后进行延迟治疗时,与安慰剂相比,Tembexa治疗在统计学上显著提高了存活率。
3.罗氏展示多项肿瘤疗法临床数据。罗氏旗下基因泰克在ASCO 2021年会上展示CD20xCD3 T细胞结合双特异性抗体mosunetuzumab和glofitamab,以及CD79b靶向抗体药物偶联物Polivy (polatuzumab vedotin)的新数据,显示对非霍奇金淋巴瘤(NHL)患者的临床获益增强。其中,mosunetuzumab与 Polivy联合治疗R/R NHL的 I/II期GO40516研究显示出良好的疗效和可接受的安全性。该方案在所有患者中实现54.5%的CR;在侵袭性NHL患者中,这些患者的CR率为47.4%。
4.诺华补体疗法治疗IgA肾病达Ⅱ期主要终点。诺华首创口服因子B抑制剂iptacopan治疗IgA肾病的Ⅱ期临床(NCT03373461)结果积极。与安慰剂相比,200mg iptacopan治疗组90天时预计将患者蛋白尿减少23%,达到主要终点指标;根据估计的肾小球滤过率(eGFR),iptacopan也显示出稳定肾功能的趋势。该研究中,iptacopan安全且耐受性良好。除了IgAN之外,诺华也正在开发iptacopan治疗多种补体驱动型肾病,包括C3肾小球疾病、非典型溶血性尿毒综合征等。
5.即用型NK细胞疗法早期临床积极。Fate Therapeutics在ASCO2021年会上公布NK细胞疗法FT516与rituximab联用,治疗复发/难治性B细胞淋巴瘤的积极Ⅰ期临床数据。在11例可评估患者中有8例达到客观缓解,包括6例达到完全缓解。这些患者既往平均接受过3种前期治疗,其中4例既往接受过自体CD19 CAR-T细胞治疗。临床中,未发现剂量限制性毒性,未发现FT516相关严重不良事件和FT516相关3级以上不良事件。
6.ADC研发公司Iksuda完成新一轮融资。Iksuda Therapeutics宣布完成数额为4700万美元的融资,用于支持其拟用于治疗B细胞血液癌症的临床前期抗体偶联药物(ADC)IKS03的开发,将这款“best-in-class”靶向CD19的ADC推进至Ⅰ期临床;以及用于扩展其有效载荷和偶联平台技术的发展。Iksuda专有的蛋白质烷基化(ProAlk)肿瘤激活有效载荷平台与偶联平台技术联合开发的ADC新药,具有克服肿瘤耐药、耐受的潜力。
医药热点
1.全国诊所设置取消审批。6月3日,《国务院关于深化“证照分离”改革进一步激发市场主体发展活力的通知》发布。本次“证照分离”改革共涉及医卫事项31项,在“全国版”中涉及医卫行业的事项共计24项。其中直接取消审批5项、审批改为备案1项、实行告知承诺2项、优化审批服务16项。5项取消的审批包括诊所设置审批、计划生育技术服务机构执业许可证、设置医疗机构批准书、职业卫生技术服务机构资格甲级证书、职业卫生技术服务机构资格丙级证书。
2.新冠病毒破坏肺部的原因或已查明。美国科学家8日在《自然·通讯》杂志上发表了首个详细的新冠病毒包膜蛋白(E蛋白)的原子级模型,该蛋白与维持肺部粘膜所必需的一种名为PALS1的人类肺细胞连接蛋白结合。该模型展示了这两种蛋白质的相互作用,有助于解释病毒如何在新冠肺炎患者中造成广泛的肺损伤,并逃逸肺部感染其他器官。这一发现可能会加快对阻断该疾病影响的药物研发进程。
3.钱巍就任君实生物首席商务官。君实生物董事长熊俊日前向员工宣布,为进一步提升公司的营销和商业化能力,公司邀请钱巍加入,担任首席商务官,将于7月初履职。钱巍加入后,将全面负责管理君实生物销售团队、策略市场部、市场部、肿瘤产品医学事务部、销售培训部等,直接汇报于董事长熊俊。
审评动向
1. CDE新药受理情况(06月08日)
申请临床:
轩竹生物的复达那非片(2个规格)、百济神州的替雷利珠单抗注射液和注射用ZW25、君实生物/苏州众合的特瑞普利单抗注射液(3个规格)、苏州盛迪亚的SHR-1314注射液、上海健信的注射用重组抗PD1/TIM3人源化双特异抗体、诺诚健华的奥布替尼片(2个规格)。
申请生产:
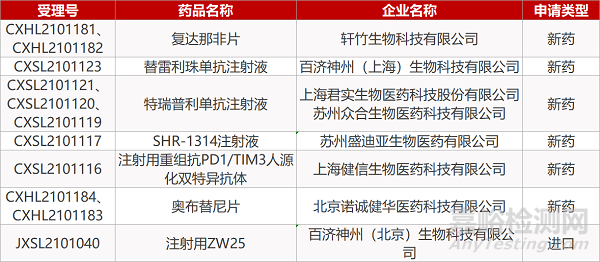
2. FDA新药获批情况(北美06月07日)

来源:药研发


