您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-10 15:24
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
国药新冠疫苗进WHO紧急使用清单。当地时间7日,世卫组织宣布将国药中生北京公司的新冠疫苗列入“紧急使用清单”。国药新冠疫苗易于储存(储存条件为2至8摄氏度),非常适用于资源匮乏的环境,而且该疫苗携带疫苗瓶监测器(疫苗瓶上的小标签会因疫苗受热而改变颜色),便于判断疫苗是否安全可用。这是世卫组织认证的第六种安全有效的高质量疫苗,也是首个获世卫组织批准的中国新冠疫苗。
国内药讯
1.歌礼乙肝新药Ⅱa期试验结果积极。歌礼恩沃利单抗(KN035,ASC22)治疗乙肝的Ⅱa期临床获积极数据。ASC22在不同剂量组(0.3、1.0、2.5 mg/kg)中均表现出良好的安全性和耐受性;ASC22单次给药12周后,患者乙肝表面抗原下降的患者比例达到8/9;其中2.5 mg/kg剂量组患者乙肝表面抗原最大降幅达1.2 log10 IU/mL。KN035是康宁杰瑞开发的一款可用于皮下注射的PD-L1单抗,歌礼拥有其用于所有病毒性疾病治疗的独家权益。
2.绿叶新冠中和抗体I期临床结果积极。绿叶制药旗下博安生物自主研发的创新新冠中和抗体LY-CovMab在中国完成了I期临床试验,LY-CovMab显示出良好的安全性和耐受性,该公司计划于近期在中国、美国和欧洲同步启动II期临床。临床前药效学研究结果显示,在治疗及预防SARS-CoV-2感染方面,LY-CovMab均具有良好疗效。此外,LY-CovMab还能有效避免ADE效应(抗体依赖的增强作用)发生。
3.加科思抗肿瘤新药JAB-21822在美获批临床。加科思药业宣布其KRAS G12C抑制剂JAB-21822的新药临床试验申请(IND)已获FDA批准。JAB-21822是KRAS G12C抑制剂中潜在的“best-in-class”项目,拟用于治疗KRAS G12C突变的晚期实体瘤患者。在中国,该新药的临床试验申请已于3月获CDE受理。加科思药业计划今年下半年在中美两国启动患者入组,开展用于非小细胞肺癌和结直肠癌肿瘤患者的临床试验。
4.再鼎医药FcRn靶向新药申报临床。再鼎医药引进品种efgartigimod注射液的临床试验申请获CDE受理。efgartigimod是argenx公司开发的具“first-in-class”潜质的FcRn靶向抗体片段,旨在减少致病性IgG抗体并阻断IgG循环。该药拟用于治疗多种已知由致病IgG抗体驱动导致的自身免疫性疾病,包括重症肌无力、寻常性天疱疮、免疫性血小板减少症、慢性炎症性脱髓鞘性多发性神经病等。再鼎医药拥有efgartigimod在大中华区的独家权益。
5.赛生医药RRx-001注射液申报临床。赛生医药1类新药RRx-001注射液的临床试验申请获CDE受理。RRx-001是EpicentRx Inc.开发的一款靶向CD47-SIRPα的小分子免疫疗法,目前正在一项III期临床REPLATINUM中用于治疗三线及以上的小细胞肺癌。赛生医药拥有RRx-001在大中华地区(包括中国大陆、香港、澳门和台湾地区)用于肿瘤治疗相关的开发和商业化的独家许可权。本次为该新药国内首次申报临床。
国际药讯
1.德国反对放弃新冠疫苗专利保护。针对美国政府日前提出的放弃新冠疫苗专利的呼吁,德国政府当地时间5月6日表示了反对意见。德国政府认为限制新冠疫苗生产的因素是生产能力和高质量标准,而不是专利。德国政府强调知识产权保护是创新的源泉。据悉,欧盟委员会主席冯·德莱恩对美国提议持“开放态度”。预计欧盟和欧洲各国领导人将于近期峰会上讨论这一议题。
2.安斯泰来恩杂鲁胺获欧盟批准新适应症。欧盟委员会批准安斯泰来特异性雄激素受体抑制剂Xtandi(恩杂鲁胺)新适应症,用于治疗转移性激素敏感性前列腺癌患者。在一项Ⅲ期ARCHS研究(NCT02677896)中,与安慰剂+雄激素剥夺疗法(ADT)相比,Xtandi联合ADT使患者的放射学进展或死亡风险显著降低61%(HR=0.39 [95% CI: 0.30-0.50];p<0.0001);而且Xtandi的安全性与已知安全性一致。
3.Moderna新冠增强型疫苗临床数据积极。Moderna公司发布增强接种第三针新冠疫苗(mRNA-1273或mRNA-1273.351)最新临床积极数据。在曾接种过两剂疫苗mRNA-1273的志愿者中,接种第三剂新冠疫苗能够显著提高对新冠突变株B.1.351和P.1的中和能力:其中mRNA-1273接种者血清对B.1.351的中和抗体几何平均滴度(GMT)达到864,而mRNA-1273.351(针对B.1.351设计)接种者这一数值高达1400;而且接种第三剂疫苗后出现的局部和全身性不良反应与此前第二剂疫苗后出现的不良反应大致相当。
4.安进银屑病药物在美申报新适应症。FDA受理安进口服PDE4抑制剂Otezla(apremilast)的补充新药申请(sNDA),用于治疗适合进行光疗或全身疗法、轻中度斑块状牛皮癣成年患者。PDUFA日期设定为2021年12月19日。该药此前在美国已获批用于治疗适合接受光疗或系统治疗的中重度斑块状银屑病患者、活动性银屑病关节炎成人患者,以及白塞氏病相关口腔溃疡成人患者等3个的适应症。
5.阿斯利康三重组合疗法达Ⅲ期临床终点。阿斯利康PD-L1单抗Imfinzi(durvalumab)、CTLA-4抗体tremelimumab与化疗联用,在一线治疗IV期非小细胞肺癌(NSCLC)患者的Ⅲ期临床POSEIDON中,达到主要终点和关键性次要终点。与单独化疗相比,该三重组合疗法显著改善患者的无进展生存期(PFS)与总生存期(OS)。Imfinzi与化疗构成的组合疗法与化疗相比,显著改善患者的PFS,但OS趋势未达统计学意义。临床中没有发现新的安全性信号。详细结果将于医学会议上报告。
6.Sarepta寡核苷酸疗法Ⅱ期临床结果积极。Sarepta Therapeutics新一代反义寡核苷酸疗法SRP-5051治疗杜氏肌营养不良(DMD)患者的国际Ⅱ期临床MOMENTUM结果积极。与每周一次eteplirsen治疗相比,每月一次剂量为30 mg/kg的SRP-5051治疗的患者体内能产生更高水平的抗肌萎缩蛋白。SRP-5051组外显子51跳跃的频率是活性对照组的18倍,抗肌萎缩蛋白的产量是对照组的8倍。该公司计划与FDA展开讨论,以进行支持加速批准的关键性临床试验。
7.Keytruda/Lenvima组合获FDA两项优先审评。FDA受理默沙东PD-1抑制剂Keytruda与卫材酪氨酸激酶抑制剂Lenvima联合用药方案的两项补充新药申请(sNDA),分别用于一线治疗肾细胞癌,以及二线治疗晚期子宫内膜癌患者。FDA同时授予这两项sNDA优先审评资格,预计今年8月底做出回复。Keytruda/Lenvima是默沙东和卫材两家公司重点开发的癌症免疫组合疗法,已于2019年9月获FDA加速批准用于治疗特定子宫内膜癌。两家公司已在超过20项临床试验中评估这一组合治疗不同类型癌症的效果。
8.IL-15激动剂组合早期临床结果积极。ImmunityBio制药公司IL-15激动剂复合体Anktiva(N-803)联合CD20单抗Rituxan(利妥昔单抗)在治疗惰性非霍奇金淋巴瘤(iNHL)的Ⅰ期临床中获积极结果。在CD20单抗敏感性的患者中,联合给药组的总缓解率为78%(7/9),所有获得缓解的患者均达到完全缓解;在CD20单抗耐药的患者中,组合疗法的总缓解率为40%(2/5),包括1例完全缓解患者;联合治疗方案耐受性良好。研究成果发表在Clinical Cancer Research上。
医药热点
1.美国群体免疫城市出现。截止4月27日,旧金山成为美国新冠疫苗接种率最高的城市,70%成人接种了至少一剂疫苗。5月2日旧金山COVID-19住院人数降低到了14人;5月5日,新增病例只有12例。此前On Point采访Dr. Fauci时,他曾认为必须达到80%接种率才能形成免疫屏障;而Biden政府最近将目标改成了7月4日70%成人接种至少一剂。从旧金山数据来看,达到疫苗接种70%这一目标后,防疫效果是显著的。
2.乙肝研究最高奖首次授予中国科学家。在日前举行的乙肝基金会成立30周年庆典上,乙肝基金会联合创始人蒂莫布洛克博士宣布:今年的布隆伯格奖获得者授予中国北京生命科学研究所(NIBS)的李文辉博士,以表彰他发现了乙肝/丁肝病毒的细胞受体。以1976年诺贝尔医学或生理学奖得主巴鲁克布隆伯格博士的名字命名的布隆伯格奖,旨在奖励给对乙肝相关科研和治疗做出重要推动和显著贡献的个人,被誉为该领域的最高荣誉。
3.广东:心理治疗纳入医保基金支付范围。为进一步健全医保目录管理机制,广东省日前发布《广东省基本医疗保险、工伤保险和生育保险诊疗项目目录(2021年)》和《广东省基本医疗保险、工伤保险和生育保险医用耗材目录(2021年)》,将于8月15日实施。这也是该省自建立基本医保制度以来,医保药品、诊疗项目、医用耗材等三大目录首次实现全省统一。值得一提的是,医用耗材目录中将治疗新冠患者所需的医用耗材“体外膜肺支持”纳入医保基金支付范围;诊疗项目目录中将心理治疗纳入医保基金支付范围。
审评动向
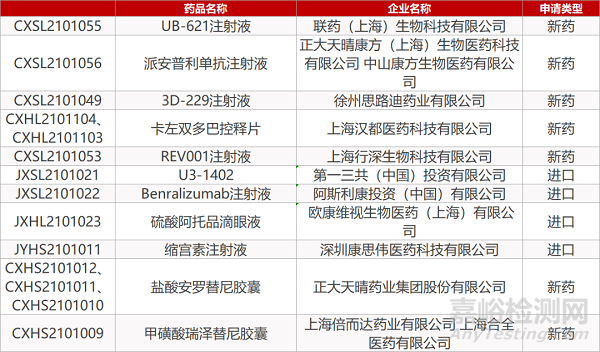
1. CDE新药受理情况(05月08日)
申请临床:
联药(上海)的UB-621注射液、正大天晴康方(上海)生物/中山康方生物的派安普利单抗注射液、思路迪药业的3D-229注射液、汉都医药的卡左双多巴控释片(2个规格)、行深生物的REV001注射液、第一三共制药的U3-1402、阿斯利康的Benralizumab注射液、 欧康维视的硫酸阿托品滴眼液。
申请生产:
康思伟医药的缩宫素注射液、正大天晴的盐酸安罗替尼胶囊(3个规格)、倍而达药业/合全医药的甲磺酸瑞泽替尼胶囊。
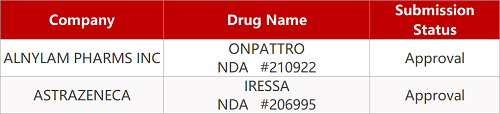
2. FDA新药获批情况(北美05月06日)

来源:Internet


