您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-09 14:12
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
武田艾替班特在华获批上市。武田醋酸艾替班特(icatibant,Firazyr)注射液上市申请审评审批状态已更新为「审批完毕-待制证 」,这意味着该药已正式在中国获批,适应症为遗传性血管水肿(HAE)急性发作。艾替班特是一款选择性缓激肽B2受体拮抗剂,为我国临床急需境外新药。公开数据显示,当前中国约有2.8万HAE患者。针对HAE患者,中国仅有一款预防类药物,尚无有效药物用于急性发作期的治疗。
国内药讯
1.康希诺新冠疫苗获智利紧急使用授权。智利卫生监管机构4月7日批准中国康希诺新冠疫苗紧急使用授权。据媒体报道,智利3月底已签署一项购买康希诺单剂疫苗的协议,疫苗到货时间预计5、6月份。该疫苗只需要注射一次,可以助力该国更多的农村人口接种疫苗。目前,智利正处于最严重的新冠病毒暴发阶段,上周达到新增8000多例病例的峰值。
2.首个GLP-1/FGF21激动剂获批两项临床。东阳光1类新药HEC88473注射液获国家药监局临床试验默认许可,拟临床用于治疗2型糖尿病和减重。HEC88473是国内首个获批临床的GLP-1/FGF21双重激动剂,有望产生降糖、减重协同效果。值得一提的是,早在2019年7月,勃林格殷格翰已布局同靶点药物,以4千万美元的预付款和8.3亿美元的里程碑付款与韩国公司Yuhan达成合作,共同开发单分子GLP-1/FGF21双重激动剂用于非酒精性脂肪性肝炎(NASH)和相关肝脏疾病。
3.「注射用双羟萘酸曲普瑞林微球」获批临床。丽珠集团2.2类化药注射用双羟萘酸曲普瑞林微球获国家药监局临床试验默示许可。这是一款长效微球制剂的促性腺激素释放激素激动剂,拟用于每三月一次肌肉注射治疗局部晚期或转移性前列腺癌。相比普通曲普瑞林注射剂,该新药具有起效时间长,减少用药次数特点,可减轻患者痛苦和用药负担,提高用药耐受性和可及性。
4.三生国健联合宜明昂科开展联合用药临床研究。三生国健的HER2靶向单抗赛普汀®(伊尼妥单抗)拟联合宜明昂科在研CD47融合蛋白IMM01开展联合用药临床研究,评估这一联合疗法用于多种HER2阳性肿瘤患者治疗的安全性,耐受性和疗效。赛普汀®是罗氏曲妥珠单抗的生物类似物,是首个国产HER2单抗。三生国健正在开展多项临床试验,包括和其他创新药物的联合应用,进一步探索和扩展伊尼妥单抗的临床适应症。
5.国内首个幽门螺杆菌23S rRNA基因突变检测试剂盒获批。国家药监局批准芯超生物创新产品「幽门螺杆菌23S rRNA基因突变检测试剂盒(PCR-荧光探针法)」的注册申请。该产品包括核酸提取试剂和扩增反应试剂,由两个包装盒组成,用于体外定性检测幽门螺杆菌感染患者胃黏膜组织样本中幽门螺杆菌23S rRNA基因两个多态性位点的三种点突变A2142 G、A2143 G 和 A2142C,为幽门螺杆菌克拉霉素耐药的临床辅助诊断。
6.百济神州新生产基地获批准开展商业化生产。百济神州宣布,国家药监局已批准其广州生物药生产基地用于开展抗PD-1抗体百泽安®(替雷利珠单抗)的商业化生产。广州生物药生产基地为百济神州全资拥有,占地超过100000平方米,获批8000升产能用于商业化生产,为中国市场生产和供应百泽安®。目前广州生物药生产基地正在进行的另一阶段建设,预计将在2022年底前完成,将使其总产能提升到64000升。
国际药讯
1.欧盟拨付1.23亿欧元用于变异新冠病毒紧急研究。欧盟委员会7日宣布,欧委会已拨付1.23亿欧元(约合1.46亿美元)的资金,用于开展变异新冠病毒的紧急研究。这笔资金来自欧盟的科研资助框架“地平线欧洲计划”。紧急研究将有助于解决短期到中期的变异新冠病毒的威胁,同时为未来做好准备,确保欧盟能够预测和更好地应对未来可能发生的流行病。
2.吉利德Trodelvy治疗三阴性乳腺癌获FDA完全批准。吉利德宣布,FDA已完全批准Trop-2靶向抗体偶联药物(ADC)Trodelvy(sacituzumab govitecan-hziy)用于既往接受过2种或2种以上全身治疗的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。此次由加速批准转为完全批准是基于Ⅲ期ASCENT研究的积极数据,Trodelvy与化疗相比,将患者中位总生存期延长至11.8个月(vs6.9个月,HR: 0.51; 95%CI: 0.41-0.62; p<0.0001),将死亡风险降低了49%。
3.渤健皮下注射那他珠单抗在欧盟获批。欧盟委员会(EC)批准渤健皮下注射(SC)剂TYSABRI®(natalizumab,那他珠单抗)用于治疗复发缓解型多发性硬化症(MS)。TYSABRI® SC给药途径的批准是基于临床研究DELIVER和REFINE的数据,这些研究表明,与每四周(Q4W)静脉注射300mg TYSABRI®相比,SC制剂在疗效、药代动力学和药效学方面具有可比性。Nnatalizumab是一款疾病修饰疗法(DMT),已在80个国家得到批准。
4.Surface Oncology靶向单抗获FDA孤儿药资格。FDA授予Surface Oncology公司CD39单抗SRF617用于治疗胰腺癌的孤儿药资格。CD39是对腺苷生成和ATP分解均至关重要的酶。腺苷的积累导致免疫抑制,而维持一定的ATP水平可促进T细胞增殖,树突状细胞成熟,增加促炎性细胞因子水平。SRF617旨在抑制CD39,从而减少细胞外腺苷并维持细胞外免疫刺激性ATP水平,促进抗肿瘤的免疫力。SRF617是首批进入临床试验阶段的CD39抗体之一。
5.辉瑞两款JAK1抑制剂遭FDA推迟3个月审查。FDA延长对辉瑞两款JAK1抑制剂abrocitinib和tofacitinib的审查期。Abrocitinib(阿布昔替尼)是一种口服小分子药物,拟用于治疗中重度特应性皮炎(AD),FDA此前已授予其突破性药物资格。另一款药物tofacitinib(托法替尼,Xeljanz/Xeljanz XR)是获批上市的首个JAK抑制剂,拟用于治疗活动性强直性脊柱炎(AS)成人患者的补充新药申请(sNDA)预计推迟至2021年第三季度初做出裁决。
6.诺华与Artios合作增强其放射性配体疗法。诺华与针对DNA损伤应答(DDR)的公司Artios Pharma达成三年期研发合作,发现并验证下一代DDR靶标,以增强诺华的放射性配体疗法(RLT)。根据协议,Artios Pharma和诺华将进行靶标发现和验证,诺华将选择至多达三个独家的DDR靶标,并获得这些靶标的全球权利与其RLT的一起使用;Artios将获得2,000万美元的预付款、研究经费和可能金额达13亿美元的里程碑付款,以及特许权使用费。
医药热点
1.北京医务人员将全部接受艾滋病诊治培训。北京市卫健委官网日前公布2021年北京市艾滋病防治工作要点:北京市医务人员将100%接受艾滋病等传染病诊治技术培训,重点提升早发现、早报告、早治疗能力;加强对艾滋病病毒感染者和病人预防疾病传播的警示性教育;做好重点病例流行病学、溯源调查工作;做好医疗卫生人员及人民警察等在职业活动中发生艾滋病病毒职业暴露的评估、处置与报告工作等。
2.处方药网售政策出台。国家发改委、商务部联合下发《关于支持海南自由贸易港建设放宽市场准入若干特别措施的意见》。意见指出,支持开展互联网处方药销售,将在海南博鳌乐城先行区建立海南电子处方中心(为处方药销售机构提供第三方信息服务),对于在国内上市销售的处方药,除国家药品管理法明确实行特殊管理的药品外,全部允许依托电子处方中心进行互联网销售,不再另行审批。
3.超1/3新冠康复者出现脑部问题。《柳叶刀-精神病学》最新发表一项研究凸显了新冠病毒对大脑健康的影响。这项回顾性研究分析了美国236379名新冠患者(2020年1月20日或之后感染新冠,并且在2020年12月13日仍然存活)的电子健康记录,发现新冠感染后被诊断出神经或精神疾病的发生率估计为33.62%,最常见的诊断是焦虑症(17%)和情绪障碍(14%);在重症患者中,神经系统疾病更为常见,近7%出现中风,近2%被诊断出痴呆症。
4.内地港澳同胞接种新冠疫苗一视同仁。国务院应对新冠病毒肺炎疫情联防联控机制综合组4月6日发出《关于做好在内地的港澳同胞接种新冠病毒疫苗有关工作的通知》。据悉,在内地工作和生活的港澳同胞可在知情自愿的前提下,凭公安部门制发的港澳居民居住证或内地医保参保凭证免费接种疫苗。有关保障政策与内地居民保持一致。
审评动向
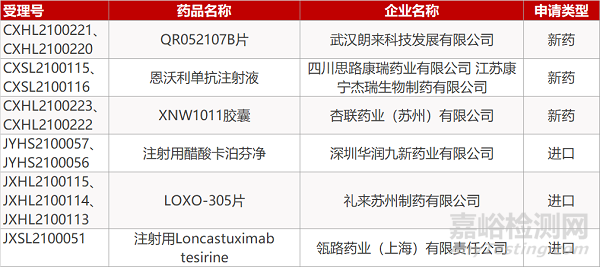
1. CDE新药受理情况(04月08日)
申请临床:
朗来科技的QR052107B片(2个规格)、思路康瑞/康宁杰瑞的恩沃利单抗注射液、杏联药业的XNW1011胶囊(2个规格)、礼来的LOXO-305片(3个规格)、瓴路药业的注射用Loncastuximab tesirine。
华润九新注射用醋酸卡泊芬净(2个规格)。

来源:药研发


