您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-10 07:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
歌礼NASH新药Ⅱ期临床中美结果一样好。歌礼旗下甘莱制药与Sagimet公司联合宣布,脂肪酸合成酶(FASN)抑制剂ASC40在治疗非酒精性脂肪性肝炎(NASH)的Ⅱ期临床的中国队列中获积极结果。与安慰剂相比,ASC40显著降低肝脏脂肪含量(28.2%vs11.1%),其肝脏脂肪含量降低≥30%的患者比例达到50%,患者ALT指标也显示出显著改善。临床中,该新药耐受性良好,无严重不良事件发生。该队列数据与在AASLD2020会议上发布的美国队列数据结果一致。
国内药讯
1.CDE针对境外已上市境内未上市化药发布新规。CDE发布《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》,进一步指导企业开展药品研发,加快境外已上市境内未上市化学药品研发上市进程,自发布之日起施行。《技术要求》适用于境外已上市境内未上市的化药,主要包括化学药品3类;以及化学药品5类(不适用于原研药品已在境内上市的化学药品5.2类)。与境外已上市境内未上市制剂关联申报的原料药也适用于该《技术要求》。
2.科伦舒尼替尼即将获批。科伦药业苹果酸舒尼替尼胶囊4类仿制上市申请进入行政审批阶段,有望近日获批,成为该品种第三个获批的仿制药。舒尼替尼是辉瑞原研的一种多靶点受体酪氨酸激酶抑制剂,主要用于治疗胃肠间质瘤、肾细胞癌和胰腺神经内分泌瘤成年患者,其2020年全球销售额为8.19亿美元。在中国公立医疗机构终端,舒尼替尼2019年销售额接近4亿元。
3.康宁杰瑞双抗KN046美国Ⅱ期注册临床获批。康宁杰瑞PD-L1/CTLA-4双抗KN046的临床试验申请获FDA批准,即将在美国开展用于治疗胸腺癌的关键Ⅱ期注册临床。KN046已于2020年9月获FDA授予用于治疗胸腺上皮肿瘤的孤儿药资格。在中国,KN046治疗胸腺癌的Ⅱ期注册临床已于今年1月启动。发布于WCLC 2020会议上的 一项Ⅰ期临床数据显示,KN046在胸腺上皮肿瘤患者中的疾病缓解率为75%,疾病控制率达100%。
4.海思科子公司转让在研TYK2产品。3月9日,海思科宣布,其控股三级子公司FronThera拟将其全资子公司FronThera U.S Holdings的全部股权转让给FL2021-001公司(美国风投公司Foresite Capital设立),FronThera公司最高有望获得合计1.8亿美元的转让款,其中包含首付款6,000万美元及最高1.2亿美元的里程碑款。此次交易,FL2021-001公司将获得一款在研口服TYK2抑制剂(FTP-637),该新药目前正在澳洲开展Ⅰ期临床。
5.依生生物申请港交所IPO。依生生物在港交所递交了IPO申请,联席保荐人为摩根士丹利和海通国际。依生生物是一家创新生物医药公司,目前拥有3个处于临床期的在研产品,包括皮卡狂犬病疫苗、皮卡YS-ON-001及皮卡YS-HBV-001;以及4种针对COVID-19、乙型肝炎病毒(HBV)、流感及癌症的临床前期在研产品。本次IPO募集资金将用于核心产品皮卡狂犬病疫苗及其他在研产品如皮卡重组新型冠状病毒疫苗等的持续研发和商业化等。
国际药讯
1.罗氏Evrysdi获欧盟CHMP推荐批准。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准罗氏(Roche)SMN2基因剪接调节剂Evrysdi(risdiplam)上市,用于治疗年龄≥2个月、临床诊断为1型/2型/3型SMA或携带1-4个SMN2拷贝的5q型脊髓性肌萎缩症(SMA)患者。Evrysdi是首个获批用于这类患者的口服疗法,也是首个可在家给药的SMA疗法。2020年8月,FDA已批准Evrysdi用于治疗2个月及以上儿童和成人SMA患者,并颁发了一张罕见儿科疾病优先审查凭证(PRV)。
2.诺华SMA基因疗法Zolgensma纳入英国医保。诺华制药脊髓性肌萎缩症(SMA)基因疗法Zolgensma(onasemnogene abeparvovec)在英国获批纳入英国国家医疗服务体系(NHS)。Zolgensma是首个获批治疗SMA的基因疗法,该疗法每剂标价高达179万英镑(合247.25万美元),患者可以通过英国NHS获得该疗法的治疗机会。价格方面,英国NHS与诺华公司达成了一定的协议折扣,但具体数额并没有对外公布。
3.吉利德艾滋病药物Biktarvy长期疗效数据积极。在第28届逆转录病毒和机会感染会议上,吉利德公布HIV三合一复方新药Biktarvy治疗初治HIV-1患者的两项III期临床(1489和1490)的积极结果。数据显示,98%开始使用Biktarvy治疗的患者在四年的随访中达到并维持了无法检测到病毒载量。在48周开放标签扩展期,从含DTG三联疗法转为Biktarvy治疗的患者中,观察到了高效和持久的病毒学抑制。研究中没有发生治疗引起的耐药性。
4.艾滋病预防疗法早期临床结果积极。默沙东核苷逆转录酶易位抑制剂islatravir(MK-8591)在一项Ⅰ期临床中获积极结果。islatravir以皮下缓释植入体(implant)的形式用药,三种不同剂量的植入体均在12周内将药物浓度维持在具有抗病毒效力的药代动力学(PK)阈值水平以上。剂量56mg islatravir预计可将药物浓度保持高于阈值一年以上。默沙东计划启动Ⅱ期临床,进一步评估islatravir皮下植入体作为HIV长效暴露前预防(PrEP)疗法的潜力。MK-8591有望只需一次用药即可提供长达12个月的保护效力。
5.AI发现15种阿尔茨海默病潜在疗法。麻省总医院(MGH)和哈佛大学医学院的联合团队基于人工智能对FDA已批准的80种药物进行了筛选,评估它们作为阿尔茨海默病(AD)疗法的潜力。他们发现了15种药物具有治疗AD的潜力,其中有5款药物属于JAK激酶抑制剂。这项研究发表在Nature Communications上。据悉,研究人员已计划启动一项临床试验,在出现轻度认知障碍或AD患者中检验JAK抑制剂baricitinib的效果。
6.罗氏阿替利珠单抗膀胱癌二线治疗不够好在美被撤回。罗氏与FDA达成共识,宣布在美国撤回PD-L1抑制剂Tecentriq(阿替利珠单抗)用于二线治疗接受过含铂化疗的转移性尿路上皮癌的适应症批准。FDA在2016年5月基于IMvigor210研究队列2的数据加速批准Tecentriq上市,用于二线治疗局部晚期或转移性尿路上皮癌。但在2017年5月更新的一项IMvigor211研究中,Tecentriq相比化疗未能显著改善患者总生存期(11.1vs10.6个月,HR=0.87)。此外,2020年5月公布的IMvigor130研究结果显示,Tecentriq联合化疗相比化疗改善了患者的mPFS(8.2vs6.3个月)。
医药热点
1.芬兰研发出鼻喷式新冠疫苗。芬兰赫尔辛基大学8日宣布,该大学与东芬兰大学合作开发出一款鼻喷式新冠疫苗。这是一款基于基因转移技术研发而成的腺病毒载体新冠疫苗。研究团队表示,由于新冠病毒可通过呼吸系统传播,疫苗选择鼻腔给药,可能在人体中引起比肌肉注射更广泛的免疫应答。该款疫苗将于几个月内在芬兰开展临床试验。
2.伦敦已有两成新冠患者出现后遗症。英国伦敦议会日前致函市长萨迪克·汗时透露,伦敦有五分之一的新冠肺炎患者会出现长期后遗症,持续时间可长达12周甚至更久。初步研究显示,年轻人以及患病时症状轻微无须入院的患者,较可能出现长期后遗症。这些患者在感染三个月后,仍有呼吸困难、疲劳、抑郁、焦虑、脱发、脑雾等情况。伦敦目前已累计有近698405人确诊感染新冠肺炎,这意味着全市有近14万人曾经或正在受到病魔的长期困扰。
3.全国人大代表建议推进淋巴瘤专科建设。全国人大代表、齐鲁制药集团李燕为两会带来《关于推进我国淋巴瘤专科建设的建议》的提案,建议政府相关部门高度重视并支持医院淋巴瘤专科建设,考虑成立全国管理指导机构,在政策引导、资金扶持等各方面,助力医院建立从公众宣传到早筛、就诊引导、规范治疗再到康复的一体化全流程诊疗体系。
审评动向
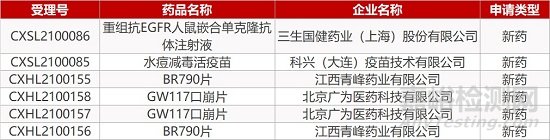
1. CDE新药受理情况(03月09日)
申请临床:
三生国健的重组抗EGFR人鼠嵌合单克隆抗体注射液、科兴(大连)疫苗的水痘减毒活疫苗、青峰药业的BR790片(2个规格)、北京广为的GW117口崩片(2个规格)。
2. FDA新药获批情况(北美03月05日)
股市资讯
【戴维医疗】公司变更医疗器械生产许可证,在原有生产产品的基础上增加了“医用空气压缩机”。
【海正药业】(1)公司的比卡鲁胺片通过一致性评价。(2)徐晓艳女士申请辞去公司高级副总裁职务。
【透景生命】公司与全资子公司透景诊断的粪便样本采集装置及检测架和粪便样本采集装置两项产品取得专利证书。

来源:药研发


