您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-24 07:58
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
北京浦润奥的伯瑞替尼拟纳入突破性疗法认定。浦润奥生物c-MET靶向1类新药伯瑞替尼(bozitinib)获CDE拟纳入突破性治疗品种,用于治疗c-MET外显子14突变的非小细胞肺癌(NSCLC)。一项在AACR2020年会上公布的Ⅰ期临床结果显示,在c-MET异常的晚期非小细胞肺癌患者中,伯瑞替尼总体耐受性良好,未出现剂量限制性毒性。在所有36例可评估患者中,伯瑞替尼的客观缓解率(ORR)为30.6%,疾病控制率(DCR)高达94.4%。
国内药讯
1.百奥泰阿达木单抗获批第6个适应症。国家药监局批准百奥泰阿达木单抗生物类似药格乐立®新适应症,用于治疗儿童斑块状银屑病。格乐立®是国内获批的首款阿达木单抗生物类似药,目前已获批的适应症为强直性脊柱炎、类风湿关节炎、 银屑病、克罗恩病、葡萄膜炎和儿童斑块状银屑病。值得一提的是,除原研外,国内仅有信达和百奥泰获批儿童斑块状银屑病适应症。
2.奥赛康塞瑞替尼首仿申报上市。奥赛康药业塞瑞替尼胶囊4类仿制上市申请获国家药监局受理,为该品种国内首家递交上市申请。塞瑞替尼(ceritinib,Zykadia)是诺华原研的一款ALK抑制剂,目前已获批进口中国,商品名为赞可达,用于治疗克唑替尼治疗后效果不佳或者出现耐药的ALK+非小细胞肺癌(NSCLC)患者,以及用于一线治疗ALK+NSCLC患者。据insight数据库,石药、先声药业、正大天晴等企业也在布局该品种仿制药市场。
3.豪森「阿美替尼」III期临床达主要终点。豪森药业宣布其第三代EGFR抑制剂阿美替尼(阿美乐®)用于一线治疗EGFR突变阳性局部晚期或转移性非小细胞肺癌(NSCLC)的III期研究达到主要终点指标,具体数据将于医学会议上公布。阿美替尼是全球范围内第二款获批的第三代EGFR抑制剂,也是首款国产第三代 EGFR 抑制剂,已于2020年3月获NMPA批准上市,用于EGFR突变阳性非小细胞肺癌的二线治疗。
4.恒瑞「氟唑帕利」Ⅲ期临床获FDA批准。恒瑞医药PARP抑制剂「氟唑帕利」的Ⅲ期临床申请获FDA批准。这是一项国际III期临床,旨在评估氟唑帕利胶囊联合醋酸阿比特龙片和泼尼松片(AA-P)对比安慰剂联合AA-P用于一线治疗转移性去势抵抗性前列腺癌患者的安全和有效性。2020年12月,氟唑帕利胶囊已在国内批准用于既往经过二线及以上化疗的伴有胚系BRCA突变的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
5.三叶草生物完成C轮融资。三叶草生物宣布完成2.3亿美元C轮融资并获得超额募集。本轮融资由高瓴创投和淡马锡共同领投,海松资本和奥博资本参投,原股东康禧全球投资基金继续加持。本轮融资将支持该公司应用其Trimer-Tag©(蛋白质三聚体化)平台继续开发和扩展研发管线,包括重组蛋白疫苗和肿瘤的生物疗法。三叶草生物计划2021上半年启动“S-三聚体”重组亚单位新冠疫苗SCB-2019国际II/III期临床和疫苗生产计划,有望在2021年供应数亿剂疫苗。
国际药讯
1.阿斯利康撤回Imfinzi膀胱癌上市资格。阿斯利康宣布,在与FDA沟通后,决定撤回PD-L1疗法Imfinzi (durvalumab) 用于二线治疗局部晚期或转移性膀胱癌的适应证批准。2017年5月,FDA基于一项I/II期Study 1108研究的积极数据加速批准Imfinzi上市,用于治疗铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌。但在确证性III期DANUBE研究中,Imfinzi 、Imfinzi + tremelimumab一线治疗不可手术切除的、IV期膀胱癌均未能较标准疗法提高患者的总生存期(OS)。
2.赛诺菲/再生元PD-1新适应症获FDA批准。FDA批准赛诺菲与再生元联合开发的PD-1抑制剂Libtayo(cemiplimab-rwlc)用于一线治疗PD-L1高表达(肿瘤比例评分≥50%)的晚期非小细胞肺癌(NSCLC)患者。一项发表于《柳叶刀》上的Ⅲ期临床数据显示,与化疗相比,Libtayo将死亡风险降低了43%。Libtayo此前已获FDA批准治疗晚期基底细胞癌和局部晚期或转移性皮肤鳞状细胞癌。
3.艾伯维JAK抑制剂达到Ⅲ期临床终点。艾伯维选择性JAK抑制剂upadacitinib在治疗中重度溃疡性结肠炎患者的第二项Ⅲ期临床中达到主要终点和所有关键性次要终点。与安慰剂组相比,upadacitinib治疗组第8周达到临床缓解的患者比例显著提高(33%vs4%,p<0.001),获得临床应答的患者比例显著提高(74%vs25%,p<0.001),达到内镜改善的患者比例显著提高(44%vs8%,p<0.001)。Upadacitinib此前已获FDA批准用于治疗中重度活动性类风湿关节炎;今年也获得欧盟批准,用于治疗活动性银屑病关节炎和活动性强直性脊柱炎。
4.辉瑞/BioNTech新冠疫苗在孕妇中开展临床研究。辉瑞与BioNTech联合开发的新冠疫苗COMIRNATY(BNT162b2,復必泰)在国际II/III期研究(NCT04754594)中完成首批受试者疫苗接种。该项研究拟招募大约有4000名18岁以上的健康孕妇在妊娠24至34周接种疫苗,两剂疫苗接种间隔为21天。每位妇女将参与该研究约7至10个月。研究将评估接种疫苗孕妇婴儿的安全性以及向婴儿传递潜在保护性抗体的情况。
5.EMA建议授予免疫疗法ilixadencel孤儿药资格。欧洲药品管理局(EMA)孤儿药委员会(COMP)建议授予Immunicum公司即用型免疫激活细胞疗法ilixadencel孤儿药资格,用于治疗胃肠道间质瘤(GIST)。ilixadencel目前正处于Ⅱ期临床开发阶段。在美国,FDA已授予其用于治疗转移性肾细胞癌的再生医学先进疗法认定;用于治疗GIST的快速通道资格;以及用于治疗肝细胞癌(HCC)和治疗软组织肉瘤(STS)的两个孤儿药资格。
6.赛诺菲将协助强生生产新冠疫苗。赛诺菲宣布与强生建立生产合作关系,将在其法国工厂为强生配制腺病毒新冠疫苗并进行瓶装。该工厂的生产力可达到每月生产约1200万剂疫苗。值得一提的是,赛诺菲此前也与辉瑞和BioNTech达成合作,将协助两家公司于2021年在欧洲生产超过1亿剂COVID-19疫苗。赛诺菲提供的协助工作将主要集中在填充药物和包装等环节,未来还可能涉及疫苗活性成分的合作,包括必要的物流支持和技术转让。
医药热点
1.医疗质量安全10项改进目标公布。国家卫健委发出《关于印发2021年国家医疗质量安全改进目标的通知》。这是我国首次从国家层面提出年度国家医疗质量安全改进目标。今年改进目标共有10项,主要涵盖心脑血管和肿瘤性疾病等重大疾病领域、病案质量和医院获得性事件等医疗管理领域,以及静脉输液率等问题比较突出的诊疗行为领域3个方面。据悉,国家医疗质量安全改进目标今后将按年度发布。
2.肺癌仍是我国死亡率最高癌症。肿瘤领域英文期刊 《国家癌症中心杂志》(JNCC)在线发表中国科学院院士、国家癌症中心主任、中国医学科学院肿瘤医院院长赫捷团队的最新研究论文《2015年中国癌症发病与死亡统计》。文章显示,2015年,我国有癌症新发病例392.9万,总死亡人数为233.8万。发病首位的癌种,男性是肺癌,女性是乳腺癌。肺癌仍是我国死亡率最高的癌症。
3.5名中国学者当选美国医学与生物工程学院院士。美国医学与生物工程学院(AIMBE)官网日前公布2021年美国医学与生物工程学院院士名单,共174名学者入选,其中包括5名中国学者:苏国辉(暨南大学)、李兰娟(浙江大学)、郑树森(浙江大学)、庞代文(南开大学)、陈春英(中国国家纳米科学技术中心)。
审评动向
1. CDE最新受理情况(02月23日)
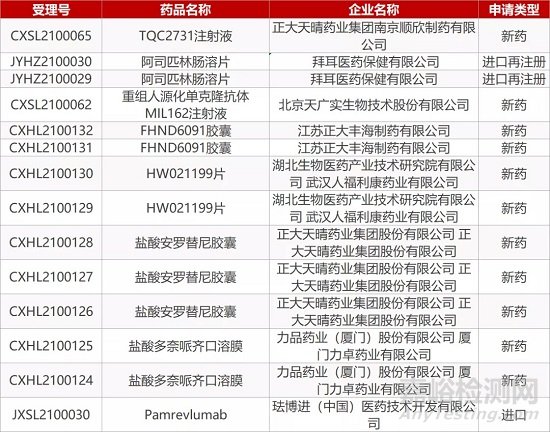
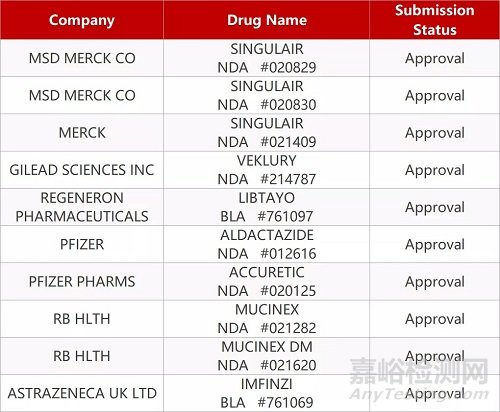
2. FDA最新获批情况(北美02月22日)
股市资讯
【君实生物】公司投资的苏州君境生物医药科技有限公司收到国家药监局核准签发的《受理通知书》,EGFR非常见突变抑制剂AP-L1898胶囊(项目代号“JS111”)的临床试验申请获得受理,JS111是一种有效抑制EGFR(表皮生长因子受体)非常见突变的靶向小分子抑制剂。
【基蛋生物】公司获国家药监局、江苏药监局颁发的《医疗器械注册证(体外诊断试剂)》:糖类抗原242检测试剂盒(化学发光免疫分析法)、促黄体生成素检测试剂盒(干式免疫荧光法)、白细胞介素-6检测试剂盒(化学发光免疫分析法)。
【普利制药】公司特利加压素注射液获得荷兰药物评价委员会(CBG)上市许可,适应症为:1、食管静脉曲张出血,特利加压素可用于食管静脉曲张急性出血的紧急治疗,其后再使用内窥镜治疗。此后,特利加压素通常被用于内镜下止血治疗的食管静脉曲张出血。2、肝肾综合征,特利加压素可用于严重肝硬化伴腹水的1型肝肾综合征(以自发性急性肾功能不全为特征)的紧急治疗。

来源:药研发


