您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-07 09:48
目的:确认无菌检查试验所需物品经无菌隔离器系统灭菌后达到预期的灭菌效果要求。
方法:通过过氧化氢气体浓度及分布状态确认、BI 挑战试验、选择性微生物挑战试验及隔离器内部环境的微生物检测(沉降菌、浮游菌、表面微生物)验证无菌隔离器的最终灭菌效果。
结论:无菌隔离器经过过氧化氢蒸汽灭菌后,舱体内物品表面的微生物被杀灭,物品内部的微生物均不受影响且过氧化氢残留对微生物无影响,无菌隔离器的系统灭菌效果达到预期要求。
无菌检查隔离器( 也称实验室隔离器,sterility testing isolator) 是为无菌检查试验提供无菌环境的一种设备,它能较好地防止微生物污染待测样品,可以避免试验用物品和辅助设备被污染,提高了无菌检查试验结果的准确性,现已在全球制药行业得到广泛应用。
目前无菌检查隔离器的灭菌通常是采用过氧化氢蒸汽灭菌剂来进行。在隔离器内部集成有过氧化氢发生器,可将高浓度的过氧化氢溶液经发生器转化为气态,均匀分布在隔离器舱体内,在一定浓度及时间的条件下进行灭菌,并在灭菌完成后利用带高效过滤器的通风系统将舱体内残留的过氧化氢蒸汽排出分解达到最终的灭菌效果。无菌检查隔离器灭菌完成后舱体内部环境的微生物负载应达到GMP 规定中A 级洁净度的要求,且灭菌过程不对物品内及试验样品的微生物有影响。
无菌检查隔离器的系统验证是保证无菌检查所需无菌环境的必要条件,而无菌隔离器的灭菌效果验证更是整个系统验证中尤为重要的验证项目之一。无菌隔离器的灭菌效果评价不仅包括灭菌对物品表面的灭菌效果评价,还包括灭菌对物品及待测样品内部微生物的影响程度评价和灭菌残留物对物品及待测样品微生物的影响程度评价。本文就无菌隔离器在最大装载量下的灭菌效果进行详细的验证研究。
1 、材料与方法
1.1 材料
STI-2400D 型无菌隔离器,供应商为杭州泰林生物技术有限责任公司;过氧化氢蒸汽化学指示剂;过氧化氢蒸汽灭菌生物指示剂;过氧化氢溶液,各种检测用培养基及实验菌株等材料。
1.2 方法
(1)菌悬液的制备。
①取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物用0.9% 无菌氯化钠溶液制备成每1ml 含菌数小于100cfu 的菌悬液15ml;菌悬液平均分装于3 小蓝盖瓶内,瓶口密封(包装形式与无菌检查供试品一致),2 ~ 8℃冰箱存放,24h 内备用。
②取白色念珠菌的新鲜培养物用0.9% 无菌氯化钠溶液制备成每1ml 含菌数小于100cfu 的菌悬液15ml。菌悬液同金黄色葡萄球菌菌悬液同法分装及保存。
③取黑曲霉的新鲜培养物加入3 ~ 5ml 含0.05%(ml/ml) 聚山梨酯80的0.9% 无菌氯化钠溶液,将孢子洗脱。然后取孢子悬液至无菌试管,用含0.05%(ml/ml)聚山梨酯80 的0.9% 无菌氯化钠溶液制成每1ml 含菌数小于100cfu 的孢子悬液15ml。菌悬液同金黄色葡萄球菌菌悬液同法分装,2 ~ 8℃冰箱存放,2 月内备用。
(2)无菌隔离器的准备。以无菌隔离器最大装载量的要求将无菌检查所需物品摆放到无菌隔离器内部相对应的位置;无菌隔离手套及舱体密封性测试合格;运行参数已确认。
(3)过氧化氢气体浓度及分布状态确认。取19 支过氧化氢蒸汽化学指示剂编号,放入无菌隔离器的手套部位、进出风口、风扇背部、舱体上下四角及垃圾桶底部,灭菌完成后观察变色情况。
(4)BI 挑战实验。取13 支过氧化氢灭菌生物指示剂(嗜热脂肪芽孢菌片)分布于无菌隔离器的8 个手套部位、左右舱门、舱体操作台面的左右及垃圾桶底部,灭菌完成后菌片取出接种于胰酪大豆胨液体培养基中,56℃培养,培养7 天,观察培养物的生长情况,同时取未经灭菌的生物指示剂3 片同法接种,作为阳性对照。
(5)无菌隔离器开启灭菌。开启无菌隔离器的自动运行程序,依次按照“自动除湿”、“自动调节”、“自动灭菌”、“自动通风”、“自动保压”五个阶段完成运行程序。
(6)沉降菌检测。取胰酪大豆胨琼脂平皿培养基15 个,摆放在隔离器舱体操作台面上,台面两侧各放置6 个平皿,台面左右两侧各放置1 个平皿,垃圾桶底部放置1 个平皿。平皿暴露采样4 小时,同时取3 只培养基作空白对照,采集完的培养基及空白对照培养基置于20 ~ 25℃培养箱中培养72 小时后,再转入30 ~ 35℃培养箱中培养48 小时,记录培养皿中菌落数量。
(7)浮游菌检测。取样点为隔离器操作平台的左右各1 个点,使用胰酪大豆胨琼脂平皿,在取样点工作区附近放置取样器,进行空气取样,各取样点的取样量为1000 升,同时取3 只培养基作空白对照,采集完的培养基及空白对照培养基置于20 ~25℃培养箱中培养72 小时后,再转入30 ~ 35℃培养箱中培养48 小时,记录培养皿中菌落数量。
(8)表面微生物的检测。取胰酪大豆胨琼脂接触碟培养基6 个分别对隔离器舱体内表面的上部、下部、左部、右部、前部、后部进行接触10 秒采样;取胰酪大豆胨琼脂接品平皿培养基(TSA)分别对8 个手套指模进行取样,同时取3 只培养基作空白对照,采集完的培养基及空白对照培养基置于20 ~25℃培养箱中培养72 小时后,再转入30 ~ 35℃培养箱中培养48 小时,记录培养皿中菌落数量。
(9)选择性微生物挑战试验。
①试验组一:选择性微生物菌悬液,小瓶密闭分装后经无菌隔离器过氧化氢蒸汽灭菌,接种计数。取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌菌悬液各1ml 接种于TSA 上,平行接种两次,30 ~ 35℃培养48 ~ 72 小时,菌落计数,取平均值;取白色念珠菌、黑曲霉菌悬液1ml 接种至沙氏葡萄琼脂培养基上,平行接种两次,30 ~ 35℃培养3 ~ 5 天,菌落计数,取平均值。
②试验组二:选择性微生物菌悬液,小瓶密闭分装后经无菌隔离器过氧化氢蒸汽灭菌,并在灭菌完成后拆开菌悬液瓶口,使内容物在无菌隔离器内暴露5min,然后同试验组一同法接种计数。阳性对照组:取保存在冰箱内同批制造的选择性微生物菌悬液,同试验组一同法接种数。
阴性对照组:另取0.9% 无菌氯化钠同法接种于TSA 及沙氏葡萄琼脂培养基上,作为阴性对照组。
2、 结果及分析
2.1 过氧化氢气体浓度及分布状态确认结果
结果显示编号1 ~ 19 的过氧化氢蒸汽化学指示剂均由绿色变为黄色,且各指示条变色后颜色基本一致,无肉眼可见的显著性差异。表明过氧化氢气态浓度在隔离器舱体内均匀分布,且达到灭菌浓度。
2.2 BI 挑战实验结果
试验结果显示编号1 ~ 13 的过氧化氢灭菌生物指示剂接种于TSB 中培养7 天后培养基无浑浊,无菌生长;阳性对照组培养7 天后培养基浑浊,有菌生长。表明无菌隔离器经过灭菌后能杀灭106 个cfu的嗜热脂肪芽孢杆菌。
2.3 沉降菌检测结果
结果显示无菌隔离器内部各采样点的沉降菌菌落数均为0cfu/ 皿。表明灭菌后的无菌隔离器内部环境达到A 级洁净度下沉降菌的相关规定。
2.4 浮游菌检测结果
隔离器操作平台的左右各1 个点的浮游菌最终菌落数均为0cfu/ 皿。表明灭菌后的无菌隔离器内部环境达到A 级洁净度下浮游菌的相关规定。
2.5 表面微生物检测结果
表面微生物检测结果显示无菌隔离器内部各采样点的表面微生物菌落数均为0cfu/ 皿。表明灭菌后的无菌隔离器内部环境达到A 级洁净度下表面微生物检测的相关要求。
2.6 选择性微生物挑战试验结果
结果显示试验组一的回收率依次为95.8%、94.7%、97.0%、94.3%、95.5%, 均在90% 以上;试验组二的回收率依次为92.9%、92.0%、95.5%、96.2%、97.0%,均在90% 以上。见表1 和表2。
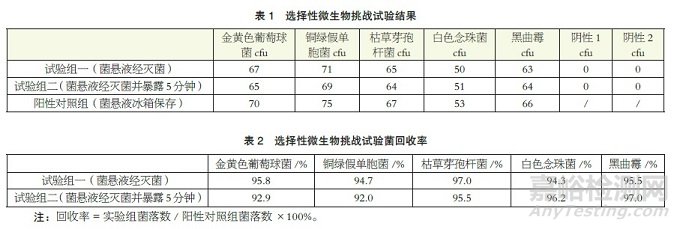
结果表明:
①无菌隔离器的灭菌过程未对物品内部微生物造成影响,即过氧化氢蒸汽灭菌不会杀灭现有包装形式的物品及供试品内部的微生物。
②无菌隔离器舱体内的过氧化氢残留对微生物无影响。
3 、讨论
本试验通过布点化学指示剂对过氧化氢蒸汽浓度分布状态进行监测,确认了无菌隔离器内的灭菌剂是均匀分布的,且达到了灭菌所需有效杀灭浓度;通过布点生物指示剂对过氧化氢蒸汽杀灭物品表面微生物的效力进行检测,确认了无菌隔离器的灭菌对表面微生物的杀灭是有效的;进而通过对灭菌后的无菌隔离器进行内部环境的浮游菌检测、沉降菌检测及表面微生物检测确认了灭菌后无菌隔离器能达到A 级洁净级别要求下的微生物水平;最后通过选取一些具有代表性的标准菌株,制成菌悬液,模拟试验样品在无菌隔离器内的整个过程。灭菌完成后,分暴露与不暴露两种状态,分别对各选择性菌株的菌悬液进行培养计数,计算回收率,以此来确认了无菌隔离器的灭菌过程不会对物品内部的微生物造成影响,以及无菌隔离器灭菌完成后的过氧化氢残留亦不会对微生物造成影响。综合分析得以证明无菌隔离器现有灭菌程序的有效性。各试验重复进行3 次可验证灭菌程序具有良好的重复性或重现性。通过本试验,为无菌隔离器的灭菌效果验证提供一种具体可行且设计优化的研究手段,能全面评价无菌隔离器的灭菌效果。

来源:成都生物制品研究所罗辉


