您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-03 17:39
在难溶性药物的溶出方法开发过程中,有时会使用到表面活性剂来提高药物的溶出,这其中可能会遇到很多“有趣”的问题,本文进行了简要分析,供广大研发人员讨论。
一、加入表面活性剂前应做哪些研究?
通常情况下,如果药典中的常规介质(如pH1.0-3.0盐酸溶液、pH4.0或4.5醋酸盐缓冲液、pH6.8磷酸盐缓冲液、水)能够使难溶性药物完全溶出,则不必考虑在溶出介质中加入表面活性剂。对于一些不能通过常规介质测定的难溶性药物,选择加入表面活性剂往往是“最后的选择”。加入表面活性剂虽然能够提高溶出,但有时可能会“掩盖”制剂的某些性能,极有可能出现体外溶出曲线相似,体内不等效的情况,因此无论有无可以参考的质量标准或溶出条件,表面活性剂的使用都应该进行详细评估,不能直接套用已有方法中的种类或浓度。
通常在确定要加入表面活性剂之前,应进行以下研究,证明制剂在截止时间内,药物在所有溶出介质中平均溶出量均达不到85%,如果有一种溶出介质达到85%以上则可以不必考虑使用表面活性剂。
(1)不含表面活性剂的常规四种或多种介质中的溶出曲线考察(0%浓度)。此时可以根据情况选择900ml或1000ml体积,在常规低转速下,如50rpm(桨法)或100篮法下进行研究,绘制自制制剂和/或参比制剂溶出曲线。
(2)提高转速(常用)。如75rpm、100rpm、150rpm等,根据USP<1092>规定,超过150rpm 的转速不推荐使用。
(3)增加采集时间,考察是否达到平台。此法比较耗时,通常确定截止时间最长为60min-120min。
(4)根据药物性质,有时可考察不同离子强度,不同盐种类的影响。
此外,还应测定药物的pH-溶解度曲线,结合以上结果确定在何种溶出量较低的介质中加入表面活性剂。
二、使用表面活性剂时应进行哪些研究?
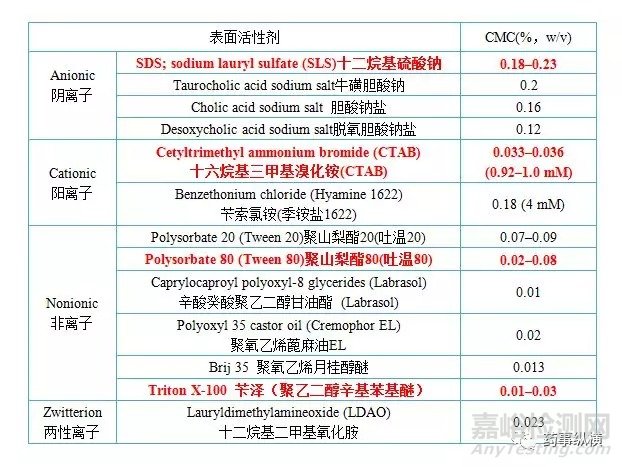
如果上述条件都不合适,可以考虑采用加入表面活性剂,此时应查询国内外文献、专利、质量标准,并结合药物结构选择表面活性剂的种类。筛选时,应根据情况考虑涵盖所有常用种类的表面活性剂,比如阴离子型、阳离子型、和非离子型。USP<1092>中列举了多种商品化的表面活性剂及其临界胶束浓度(Critical Micelle Concentration,CMC)的近似临界值,在方法开发中可以参考。
常见表面活性剂的种类及临界胶束浓度
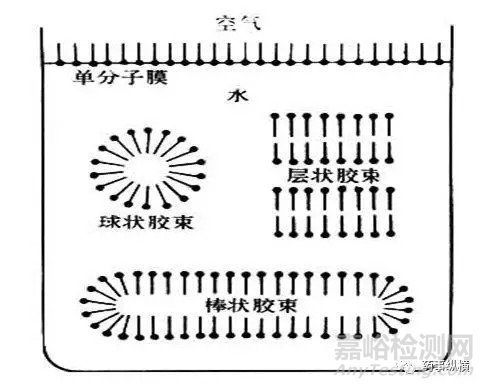
胶束的概念由Mcbain在1925年首次提出,认为当浓度升至一定值时,表面活性剂分子在水溶液中从单体缔合为“胶态聚集态”,并称之为“胶束”,所形成的这些胶束是热力学稳定的,从而将形成胶束时的浓度称之为临界胶束浓度,简称CMC。
一般认为,在表面活性剂浓度不大时,没有其他添加剂的溶液中胶束大多呈球状,在十倍于CMC或更浓的溶液中,胶束一般为非球状,如棒状;随着溶液浓度的不断增加,棒状胶束聚集呈束状,浓度更大时形成层状。
含有表面活性剂溶液中一旦形成了胶束后,溶液的一系列化学性质将会会发生改变,例如表面张力、渗透压、润湿、增溶、乳化、起泡等。CMC受无机盐、有机添加剂和氢离子浓度的影响。
USP<1092>表中所列表面活性剂并不全面,不能排除未列出的表面活性剂。其他表面活性剂,如羟丙基β-环糊精,已被用来作为溶出介质添加剂提高难溶性化合物的溶解度。在这些表面活性剂中最常用有CTAB、SDS、吐温80和Triton X-100。
根据USP<1092>规定,一般情况下,表面活性剂的浓度应高于它的CM,但在实际工作中往往低于CMC浓度或在其范围内的情况也能够使溶出符合要求,因此USP<1092>的规定并不代表一定要高于CMC浓度,应具体问题具体分析。
不同级别(或纯度)的表面活性剂会影响药物的溶解度,因此要对表面活性剂的级别和纯度进行详细的对比研究和必要的控制,例如,SDS应使用高纯度级并固定厂家来源。吐温80的纯度和来源影响外观(颜色)及其中的杂质含量,在使用HPLC方法进行分析时,不同来源的吐温80往往会表现出不同的杂质行为,对色谱柱及色谱条件要求较高。此外,反离子或pH值可能会影响表面活性剂溶液的溶解性或稳定性,例如,当含有SDS的磷酸盐缓冲液中钾盐浓度为0.5mol/L时,就会形成沉淀析出,但是使用其钠盐制备含有SDS的介质时,就可以避免这种现象发生。
关于表面活性剂的使用量,在《普通口服固体制剂溶出曲线测定与比较指导原则》中规定:表面活性剂浓度推荐在0.01%-1.0%(W/V)范围内依次递增考察,特殊品种可适度增加浓度。说明表面活性剂通常考察在0.01%-1.0%之间,必要时可以考虑超过上述浓度,此时应有研究说明。
日本《仿制药生物等效性试验指导原则2012版》中规定:吐温-80的浓度应从0.01%、0.1%、0.5%和1.0%(W/V)依次递增。增加时,只要pH1.2、pH4.0和pH6.8任何一个介质中,参比制剂在规定的时间内平均溶出率达85%以上,则设定该介质中的吐温-80浓度作为溶出度试验用最低浓度。如果递增至最高浓度,参比制剂在规定时间内平均溶出率仍达不到 85%,则设定溶出速率最快介质中的吐温-80浓度作为溶出度试验用浓度。如果吐温-80与药物本身或添加剂反应,影响药物的溶出,则将缓冲溶液从磷酸二氢钙换成磷酸二氢钠,使用十二烷基硫酸钠亦可。但使用十二烷基硫酸钠的药物溶解度,不能超过吐温-80最大浓度的溶解度。
USP等国外药典标准或FDA溶出数据库中公开的含有表面活性剂的溶出介质一般都含有较高的浓度,往往不具有区分力,需要降低浓度进行对比研究。进行不同种类的表面活性剂的不同浓度筛选时,可以使用6杯或12杯溶出仪进行筛选,如每种介质平行做2片参比制剂(或仿制制剂),一次可以做3或6种,或者不同浓度的对比试验。目标是确定使药物在合适时间(如60-120min)达到85%以上所需要的最低量。表面活性剂逐渐增加的浓度也常见0%、0.1%、0.25%、0.5%、0.75%、1.0%、2.0%情况,研究时宜逐级进行考察。
三、使用表面活性剂时的案例分析
表面活性剂的种类、浓度、来源、纯度、级别、与介质中添加剂的相容性问题是常规考察项,必须进行研究。除此之外,表面活性剂与药物本身的相互作用情况也不容忽视。
案例1:药物与SDS发生相互作用
药物离子与表面活性剂之间的离子对相互作用在溶出介质中经常发生,可导致药物溶出不完全。本例中碱性药物B(pKa为4.9、5.6)在pH4.5以下溶解度很高,没有区分力,因此考察4.5以上的溶出情况,而由于在此范围内溶解度又很低,因此考虑加入SDS进行考察。
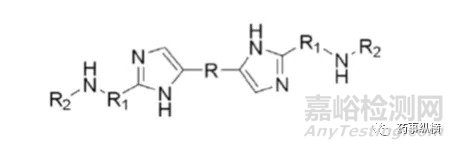
药物B的化学结构
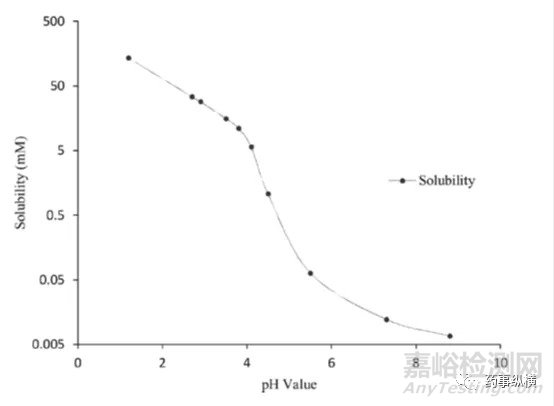
药物B的pH-溶解度曲线
研究中发现,在含有低于CMC浓度的SDS的pH4.5介质中形成了不溶性盐,影响了药物的溶解度和制剂的润湿性,而在高pH时这种现象不明显。pH4.5介质中,当SDS浓度高于CMC浓度时,其溶出也比不加SDS的情况慢。
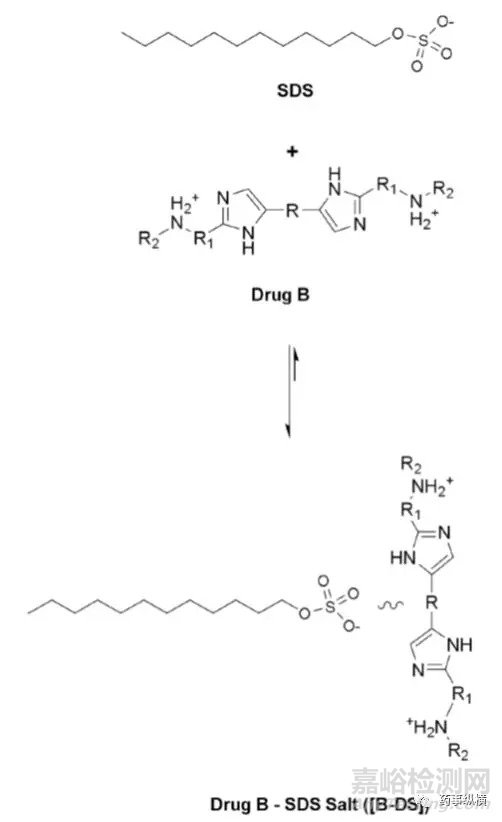
药物B与SDS成盐示意图
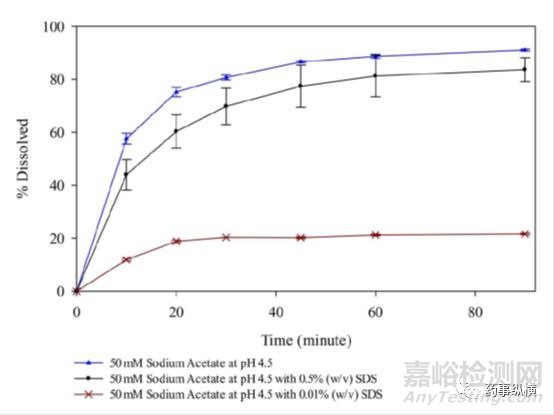
含不同浓度SDS的pH4.5介质溶出曲线
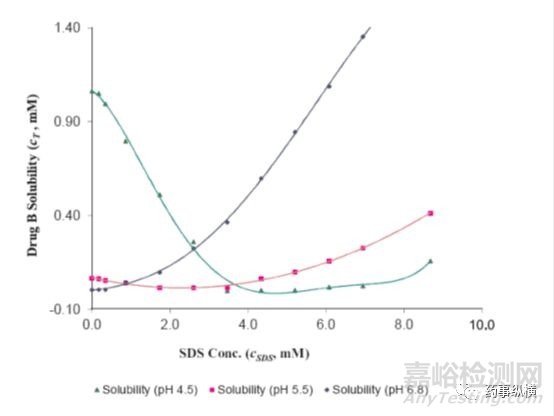
药物B在不同SDS浓度pH4.5、pH5.5、pH6.8介质中的溶解度
根据上述研究,最后选择了非离子表面活性剂。本例说明在对离子型药物进行溶出研究时,应考虑到药物与离子型表面活性剂的相容性,相容性与介质pH环境、缓冲液种类、离子强度等有关。
本例药物B在pH4.5介质中的溶出低是由于介质中加入SDS形成难溶性盐引起的,这种情况在体内可能是并不存在的,也许药物B已经满足BE了。因此,对于碱性药物,需要注意介质中加入SDS后可能导致错误的判断。
案例2:表面活性剂溶液增加了药物的稳定性
利福平与异烟肼复方制剂在进行溶出曲线测定时发现利福平在0.1N盐酸中不稳定,发生降解。由于利福平在水中不溶,因此采用了0.4%SDS溶液进行了研究,结果表明在整个分析检测过程中无降解。而且,0.4%SDS溶液的体内外相关性很好。
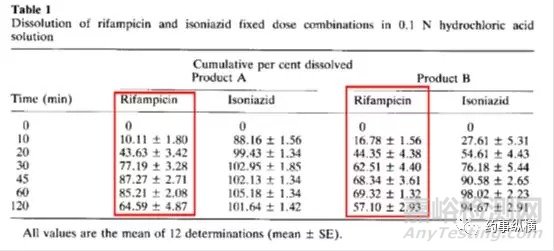
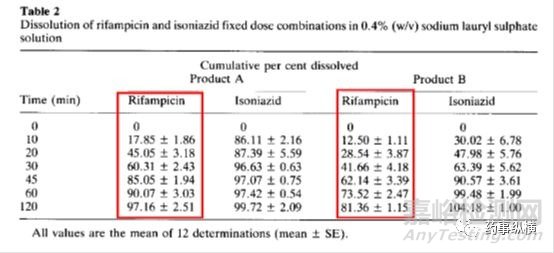
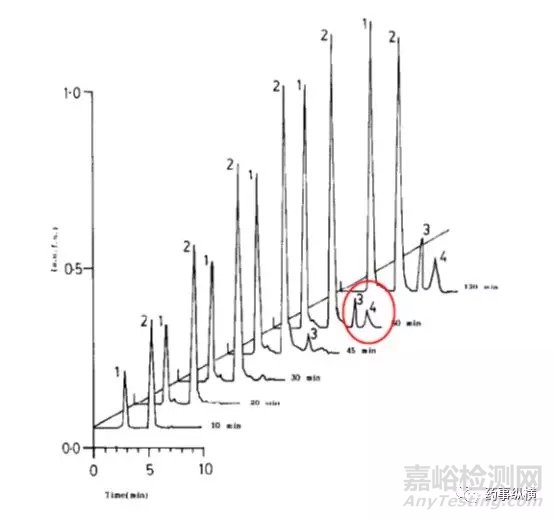
利福平在酸溶液中的降解情况(3、4为两个降解物峰)
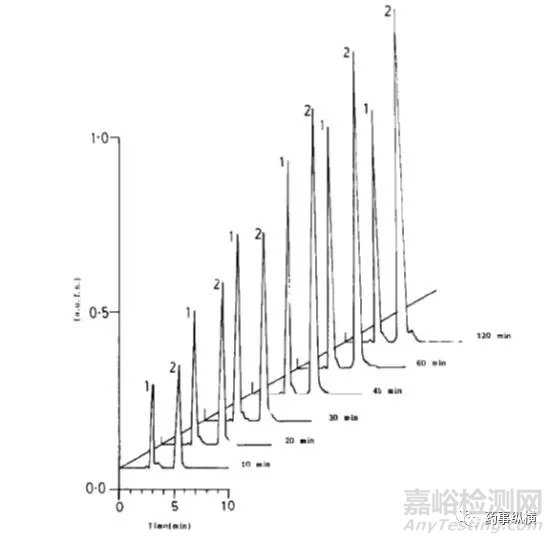
利福平在0.4%SDS溶液中的情况(无3、4两个降解物峰)
通过总结可知,表面活性剂在溶出过程中可能涉及如下作用:降低溶出介质表面张力、增加制剂润湿性促进了药物溶出;与药物不相容(成盐或促进降解),降低了药物溶出;与介质不相容(如SDS与钾盐),形成沉淀;使药物在表面活性剂溶液中更稳定等。其他类型的表面活性剂在使用时(如溶出或处方中用到),类似问题也需引起总结和思考。
参考文献
1、USP <1092>:溶出度方法的开发与验证
2、《普通口服固体制剂溶出曲线测定与比较指导原则》
3、《仿制药生物等效性试验指导原则2012版》
4、Zongyun Huang, Shuchi Parikh, William P. Fish.Interactions between a poorly soluble cationic drug and sodium dodecylsulfate in dissolution medium and their impact on in vitro dissolution behavior[J]. International Journal of Pharmaceutics,535 (2018) 350–359
5、K.C. Jindal, R. S. Chaudhary, A. K. Singla, S. S. Gangwal, S. Khanna.Dissolution test method for rifampicin—isoniazid fixed dose formulations[J].Journal of Pharmaceutical and Biomedical Analysis, Volume 12, Issue 4, April 1994, Pages 493-497

来源:Internet


