您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-26 09:09
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
罗氏流感新药Xofluza获FDA批准新适应症。FDA批准罗氏与盐野义制药联合开发的抗病毒新药Xofluza (baloxavir marboxil)的补充新药申请,用于12岁及以上人群在接触流感患者后的预防流感(称为“暴露后预防”)。Xofluza也是首个获批用于暴露后预防的单剂量流感药物,只需服用一次就可以见效。在美国,Xofluza此前已获批用于治疗12岁及以上的急性、无并发症的A型和B型流感患者。
国内药讯
1.豪森药业2款仿制药申报上市。豪森两款仿制药的上市申请获CDE受理,分别为3类仿制药醋酸艾替班特注射液和地拉罗司片,目前两个品种国内均无企业获批。艾替班特是武田旗下夏尔制药开发的一款高选择性缓激肽B2受体拮抗剂,主要用于治疗遗传性血管水肿(HAE)急性发作。地拉罗司是FDA批准的首个能够常规使用的口服铁螯合剂,由诺华原研,其口服混悬液和分散片,获批用于治疗2岁及以上小儿和成年患者因输血而引起的慢性铁过载,和10岁以上非输血依赖性地中海贫血(NTDT)综合征患者的慢性铁过载。
2.正大天晴奥美沙坦酯氨氯地平片即将获批。正大天晴4类仿制药奥美沙坦酯氨氯地平片审评状态变更为「在审批」,预计即将获批成为国内首仿,并视同通过一致性评价。奥美沙坦酯氨氯地平片是由血管紧张素Ⅱ受体拮抗剂(ARB)奥美沙坦酯和钙通道阻滞剂(CBB)氨氯地平组成的一款复方药,用于高血压治疗。目前该品种在国内除第一三共原研产品思卫卡外,尚无其他企业获批。
3.恒瑞卡瑞利珠组合拟纳入突破性疗法。恒瑞PD-1卡瑞利珠单抗和抗血管生成药苹果酸法米替尼获CDE纳入拟突破性治疗品种公示名单,卡瑞利珠联合法米替尼用于治疗经过一线及以上治疗失败的复发转移性宫颈癌。在ESMO 2020年会上,恒瑞披露了这一联合疗法治疗晚期妇科肿瘤的Ⅱ期研究数据。在18例可评估的宫颈癌患者中,ORR为61.1%,DCR为 83.3%;而且这一组合疗法的不良反应可控。
4.石药抗体偶联药物获FDA孤儿药资格。石药集团旗下中奇制药抗体偶联药物SYSA1801获FDA授予针对胃癌(包括胃食管交界处癌)治疗的孤儿药资格。SYSA1801是一种抗Claudin 18.2单抗与MMAE连接起来生成的抗体偶联药物。临床前体外和体内的动物实验显示,SYSA1801能有效通过抗Claudin 18.2抗体靶向肿瘤细胞并发生内吞,将MMAE毒素带入肿瘤细胞而起到治疗胃癌和胰腺癌的作用。中奇制药计划于2021年提交SYSA1801于中国及美国的临床试验申请。
5.礼来BTK抑制剂在华获批临床。礼来1类新药LOXO-305获两项临床试验默示许可,适应症为:慢性淋巴细胞白血病/小淋巴细胞淋巴瘤;套细胞淋巴瘤;其他B细胞非霍奇金淋巴瘤。该新药是由精准疗法公司Loxo Oncology(已被礼来收购)开发的一种高度特异性、非共价BTK抑制剂,目前正在全球范围内开展Ⅰ/Ⅱ期临床试验。今年9月,LOXO-305用于治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)获得了FDA授予的孤儿药资格。
6.德琪医药第二代SINE化合物获批临床。德琪医药1类新药ATG-016片(eltanexor)获国家药监局临床试验默示许可,拟开发用于治疗去甲基化药物(HMA)治疗失败的IPSS-R(一种预后积分系统)中危及以上骨髓增生异常综合征(MDS)患者。ATG-016是一款二代选择性核输出抑制剂(SINE)化合物,已在一项针对患有高危MDS老年患者的Ⅰ/Ⅱ期临床中观察到阳性结果。在20例可评估患者中,7例获得骨髓完全缓解(mCR),ORR为35%。
国际药讯
1.欧洲首个食管癌免疫疗法获批。欧盟委员会批准百时美施贵宝Opdivo(nivolumab,纳武利尤单抗),用于治疗既往接受过氟嘧啶和铂联合化疗的不能切除的、晚期、复发或转移性食管鳞状细胞癌(ESCC)成人患者。Opdivo也是欧盟批准的首款用于一种胃食管癌症的免疫疗法。在一项Ⅲ期ATTRACTION-3试验中,与化疗(多西紫杉醇或紫杉醇)相比,Opdivo将死亡风险降低23%(HR=0.77,95%CI:0.62-0.96;p=0.019);两个治疗组中位OS为10.9个月(95%CI:9.2-13.3)和8.4个月(95%CI:7.2-9.9)。
2.FDA批准三年里第三款RNAi药物。继上周获欧盟批准上市后,Alnylam公司RNAi疗法Oxlumo(lumasiran)又获得FDA批准上市,治疗1型原发性高草酸尿症(PH1)。这是FDA三年内批准的第三款RNAi疗法,也是其今年批准的第44款疗法。Lumasiran是Alnylam公司专有的增强稳定化学-GalNAc递送技术平台开发的一款皮下注射RNAi疗法,靶向编码肝脏中乙醇酸氧化酶(GO)的HAO1基因的mRNA,并通过降低GO的表达来降低肝脏草酸盐的产生。
3.BrainEver重组蛋白BREN-02获FDA孤儿药资格。FDA授予BrainEver公司BREN-02(重组人源蛋白Engrailed-1,rhEN1)孤儿药资格,用于治疗肌萎缩侧索硬化(ALS)。临床前研究表明,同源异形蛋白质EN1对于脊髓α运动神经元的存活和维持起重要作用。临床前模型中,通过腰椎鞘内注射BREN-02可以恢复肌肉功能并防止运动神经元死亡。BrainEver公司计划于2021年启动BREN-02治疗ALS患者的临床研究。
4.BMS联手Schrödinger开发小分子靶向药。专注于利用计算平台加速药物开发和材料设计的Schrödinger公司与百时美施贵宝达成合作,将在肿瘤、免疫和神经疾病领域发现、开发和商业化小分子靶向药。本次合作包括Schrödinger的两个早期项目(靶向HIF-2 α的小分子和靶向SOS1/KRAS的小分子)和其他未公开靶点的化合物。根据协议,Schrödinger将获得5500万美元预付款,高达27亿美元的里程碑付款,以及产品的销售分成;Schrödinger将负责为每个靶标发现候选药物,BMS将负责候选药物的开发、制造和商业化。
5.美国AAM敦促 FDA 重新审视亚硝胺问题。美国仿制药和生物类似药企业协会--普享药协会(AAM)于10月份发表了一份关于亚硝胺的白皮书,敦促FDA重新审视和重新评估药品中亚硝胺的安全性限度,同时还提出了一种“科学驱动的”基于风险的方法来评估药物中亚硝胺的潜在存在。采用基于风险的方法,申办人将根据 API 的结构、API 的生产、辅料、包装以及其他因素,对亚硝胺的潜在来源进行评估,以确定与药品制剂相关的风险水平(风险概况)。根据风险概况,申办人将确定控制措施以减少相关风险。
医药热点
1.美国或下月中旬启动新冠疫苗接种。美国疫苗和药物攻关计划“曲速行动”首席顾问蒙塞夫·斯拉维22日现身多家电视台,宣介政府新冠疫苗接种计划。他说,12月中旬抗疫一线医护人员等有望率先接种美德药企联合研发的新冠疫苗。斯拉维说,美国3.3亿人口中大约70%须接种新冠疫苗以实现“群体免疫”,这一目标可能在明年5月达成。他预估将有2000万美国民众在12月接种疫苗。
2.集采未中选“价高药”个人自付比例提高。11月23日,上海市发布《关于做好第三批国家组织药品集中采购和使用有关工作的通知》,通知表示,属于上海市医保(2019 年版)但价格高于中选价格的同通用名未中选药品,在梯度降价或限价后挂网公开议价采购后,对「价高药」适当提高个人自付比例。这个比例是10%(基本药物和医保甲类支付的药品)或20%(其他药品)。
3.我国基本养老保险基金规模超万亿。人力资源和社会保障部24日公布的《基本养老保险基金受托运营2019年度报告》显示,截至2019年底,各省份委托全国社会保障基金理事会投资运营的基本养老保险基金资产总额10767.8亿元,当年投资收益额663.86亿元,投资收益率9.03%。据人社部相关负责人介绍,自2016年底正式启动市场化投资运营以来,基本养老保险基金已累计投资收益额850.69亿元。
股市资讯
【科伦药业】公司产品“唑来膦酸注射液”通过仿制药一致性评价,该产品用于治疗绝经后妇女与成年男性的骨质疏松症,为2019版国家医保目录品种,2019年中国销售额9.2亿元。
【安科生物】控股子公司“重组抗HER2人源化HuA21单克隆抗体注射液”获得药物临床试验默示许可,该产品是自主开发的一款创新型HER2单克隆抗体,用于治疗HER2过表达肿瘤。
【君实生物】公司产品注射用重组人源化抗Trop2单抗-Tub196偶联剂(JS108)的I期临床研究已完成首例患者给药。
审评动向
1. CDE最新受理情况(11月25日)
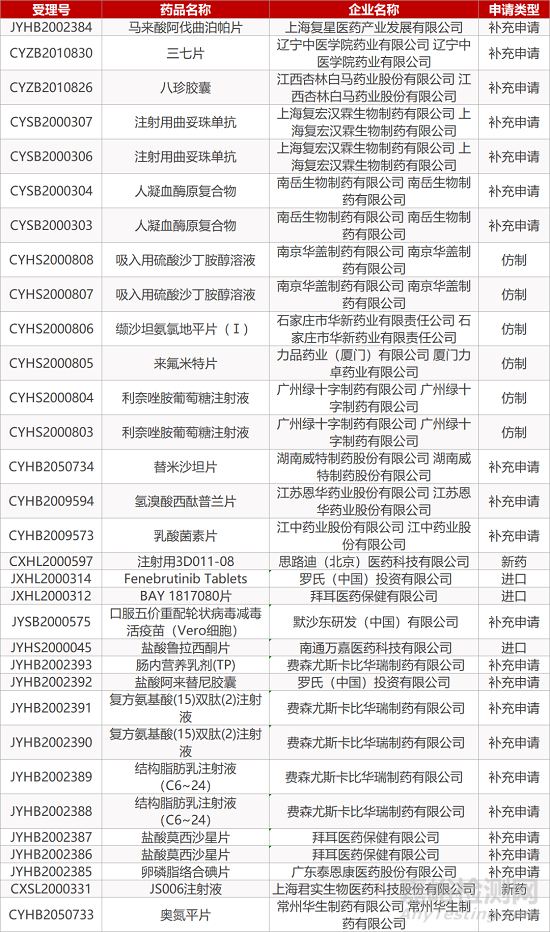
暂无
- The End -

来源:药研发


