您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2020-09-20 16:54
随着生命科学技术的进步,PCR成为当下“最热”的检测技术之一。许多生物实验室都会进行PCR实验,正确掌握PCR的原理及检测方法对我们的科研将是如虎添翼。
PCR (polymerase chain reaction)聚合酶链式反应,又称体外DNA扩增技术,在1985年由美国Cetus公司的Kary Mullis首创,可以将微量目的DNA片段扩增一百万倍以上。Kary Mullis本人因此获1993年诺贝尔化学奖。
优点:敏感度高、特异性强、产率高、重复性好以及快速简便等,广泛应用于微生物学、考古学、 法医学及体育等领域,并已普及到许多普通实验室, 大大简化了传统的分子克隆技术,从而比较容易地 对目的基因进行分析、鉴定。
PCR的原理
用于扩增位于两段已知序列之间的DNA片段,类似于天然DNA的复制过程。以拟扩增的DNA分子为模板,以一对分别与模板5'末端和3'末端互补的寡核苷酸片段为引物, 在DNA聚合酶的作用下,按照半保留复制的机制沿着模板链延伸直至完成新的DNA合成,重复这一过 程,即可使目的DNA片段得到扩增。
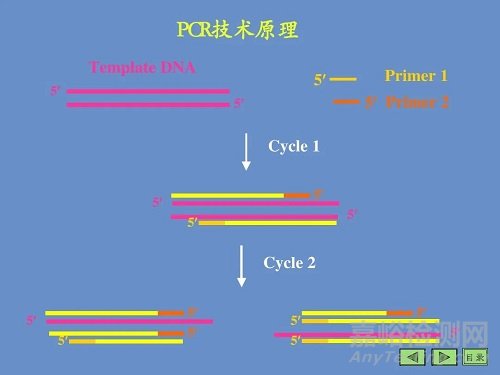
PCR基本反应步骤
扩增的特异性取决于引物与模板DNA的特易结合,基本反应步骤分三步:
1、变性(Denaturation):
加热使模板DNA双链间的氢键断裂而形成两条单链。
94°C 30〃
2、退火(复性)(Annealling):
突然降温后模板DNA与引物按碱基配对原则互补结合,也存在两条模板链之间的结合,但由于引物的高浓度,结构简单的特点,主要的结合发生在模板与引物之间。
55°C 30〃
3.延伸(Extension):
将反应温度调节到酶的最适温度,在DNA聚合 酶、4种dNTPs及镁离子等存在的条件下,以引物的3'端开始,结合单核昔酸,形成与模板链互补的新DNA链。
72°C 1〃
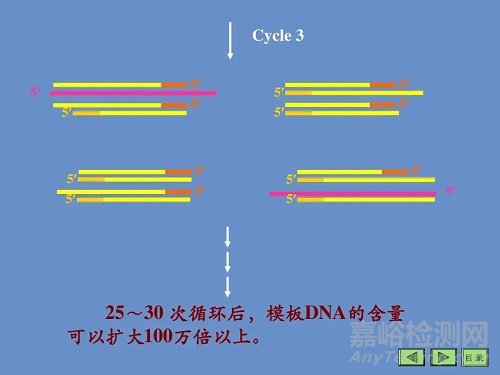
上述3步为一个循环,每经过一个循环,样本 中的DNA量应该增加一倍,新形成的链又可成为新一轮循环的模板,经过25〜40个循环后DNA可扩增106 〜109 倍。
PCR扩增的特异性是由一对寡核苷酸引物所决定的。
反应初期,原来的DNA担负起使模板的作用,随着循环次数的递增,由引物介导延伸的 片段急剧增多而成为主要模板,最终的扩增产物是介于两种引物5'端之间的DNA片段。
PCR的成分和作用
1、缓冲液:
10~50 mM Tris- Cl (pH8.4)
维持Taq酶作用环境的偏碱性
25~50 mM KCl
促进引物退火,>50 mM会抑制Taq酶的活性。
100μg/ml牛血清白蛋白(BSA)
对酶有一定的保护性,如质量不好将起相反的作用,建议使用乙酰化的BSA。明胶、Tween-20、二硫苏糖醇(DTT)也有类似作用。
2、MgCl2:
L5~2e0 mM
Taq酶具有Mg2+依赖性,显著影响反应 的特异性和扩增片段的产量,过量能增加非特异扩增并影响产率,过低则酶活性显著下降。
3、dNTPs :
dATP、dGTP、dCTP、dTTP—底物
0.02 〜0.2 mM
dNTPs可与Mg2+结合,应注意Mg2+浓 度与dNTPs浓度之间的关系,Mg2+浓度比 dNTPs 浓度高 0.2~2.5 mM。
过高:加快反应速度,还可增加碱基的错误掺入率和室验成本。
过低:反应速度下降,可提高实验的精确性。
4、引物(Primer-P):
预扩增核酸片段两端的已知序列,决定特异性。0.2~1 μM
偏高:非特异产物扩增及错配,增加引物之间形成引物二聚体,产量降低。
偏低:产量降低。
5、Taq DNA聚合酶:
耐高热
0.5~5 U/100μL
1U/25~50μL
偏高:引物非特异产物的扩增。
偏低:产物量降低。
6、模板DNA (Template):
最低102~105 bpDNA片段,实际用量远远 超过此量,用量需在实验中摸索。1~5μL。
过高:非特异产物增加
过低:产量降低
7、水:
去离子水,补足整个反应体积。
PCR反应条件优化
1、变性温度和时间:
保证模板DNA解链完全是保证整个PCR扩增成功的关键。
加热90~95°C, 30~60s,再复杂的DNA 分子也可变性为单链。根据模板DNA复杂程度,可以调整变性温度和时间。一般情况下选择90°C 30〃,可使各种复杂的DNA分子完全变性。
温度过高或高温持续时间过长,可对Taq酶活性和dNTP分子造成损害。
2、复性温度和时间:
PCR扩增特异性取决于复性过程中引物与模板的结合。
复性温度的选择,可根据引物的长度和G+C含 量确定,长度在15~25 bp之间时,复性温度Tm=4(G+C)+2(A+T)计算得到,一般位于40~600°C,30~60s。
复性温度越高,产物特异性越高。复性温度越低,产物特异性越低。
一般情况下选择55°C 30〃足以使引物与模板 之间完全结合。
3、延伸温度和时间:
一般位于Taq酶最适作用温度70~75°C之间。引物小于16个核苷酸时,过高的延伸温度不利于引物与模板的结合,可以缓慢升温到70~75°C。
延伸反应时间,可根据待扩增片段的长度而定,<1Kb, 1分钟足够;>1Kb需加长延伸时间,10Kb片段延伸时间可达15分钟。
延伸时间过长可出现非特异扩增,常用72°C 1〃。
4、循环数:
其他参数选定后,PCR循环次数主要取决于模板DNA的浓度。
理论上说20〜25次循环后,PCR产物的积累即可达到最大值,实际操作中由于每步反应的产率不可能达到100%,因此不管模板浓度是多少,20~30次是比较合理的循环次数。循环次数越多,非特异扩增增加。

来源:Internet


