您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-22 09:24
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
《柳叶刀》发布康希诺/陈薇团队新冠疫苗Ⅱ期结果。陈薇团队联合康希诺在《柳叶刀》上发布Ad5新冠疫苗Ⅱ期临床研究结果。508名志愿者接受一剂新冠疫苗(高剂量组,1E11 病毒颗粒,n=253;低剂量组,5E10病毒颗粒,n=129)或安慰剂(n=126)的注射。第28天,96%(高剂量组)和97%(低剂量组)的志愿者产生能够与S蛋白受体结合域(RBD)结合的抗体,ELISA检测的峰值分别为656.5和571.0,两组中和抗体滴度达到19.5和18.3;两组产生显著细胞免疫反应的比例为90%和88%;两组不良事件发生率为72%和74%,无严重不良事件发生。
国内药讯
1.再鼎引进品种瑞普替尼在中国申报上市。7月20日,再鼎医药和Deciphera Pharmaceuticals宣布,NMPA已受理酪氨酸激酶开关控制抑制剂瑞普替尼的新药上市申请,用于治疗已接受过包括伊马替尼在内的3种或更多种激酶抑制剂治疗的晚期胃肠道间质瘤(GIST)成人患者。瑞普替尼近期已在美国、加拿大和澳大利亚获批上市,商品名为Qinlock。在一项III期研究INVICTUS中,瑞普替尼组中位无进展生存期为6.3个月,而安慰剂组仅为1.0个月,并且疾病进展或死亡的风险显著降低了85%(危险比0.15,p <0.0001)。
2.歌礼制药NASH候选药完成中国桥接试验。歌礼制药脂肪酸合成酶抑制剂ASC40(TVB-2640)用于非酒精性脂肪性肝炎(NASH)的中国药代动力学桥接试验结果积极。ASC40 的25 mg、50 mg和75 mg剂量组的药代动力学参数具有线性关系;ASC40显示出良好的耐受性和安全性;并且中国受试者的主要药代动力学参数与美国受试者的结果一致。值得一提的是,该产品六月份公布的Ⅱ期研究数据显示:TVB-2640显著降低了肝脏脂肪含量(主要疗效终点),在50mg剂量组中应答率为61%。
3.复星引进的新冠mRNA疫苗获批临床。复星医药宣布其获德国BioNTech公司授权的新冠病毒mRNA疫苗(BNT162b1),已于7月16日获得NMPA临床试验批准。这距离该产品7月14日临床试验申请获得NMPA受理仅过去2天。据悉,该疫苗Ⅰ期临床试验将由江苏省疾控中心(江苏省公共卫生研究院)负责,试验现场位于泰州中国医药城疫苗工程中心,泰州市疾控中心、泰州市人民医院等单位共同参与。志愿者的网上招募工作即将展开。
4.百济神州与Assembly达成战略合作。百济神州与Assembly Biosciences就Assembly临床阶段的3款用于治疗乙肝的核心抑制剂达成合作许可协议。根据协议,百济神州将获ABI-H0731、ABI-H2158及ABI-H3733在中国(包括港澳台地区)独家开发和商业化的权利;百济神州将负责在中国的开发、药政注册以及商业化活动;Assembly将获4000万美元的现金预付款、可能高达5亿美元的潜在里程碑付款以及产品销售分成。百济神州将为在中国的临床开发注入初始资金,但此后在协议地区的开发成本将由双方平摊。
5.药明巨诺完成对Syracuse 公司的收购。药明巨诺宣布完成对Syracuse Biopharma(香港)公司的收购,并获得Eureka Therapeutics(优瑞科生物)专有的针对实体肿瘤的ARTEMIS® antibody TCR技术在中国及东南亚国家的授权许可。收购细节并未透露。优瑞科生物是一家致力于开发针对实体瘤的新型T细胞疗法的生物制药公司。Syracuse Biopharma由优瑞科生物于2017年成立,致力于在中国和东盟国家开发和商业化优瑞科的抗体项目,目前拥有拟用于肝细胞癌(HCC)的AFP靶向的ARTEMIS®临床项目。
国际药讯
1.首创SINE抑制剂Xpovio第3个适应症获FDA受理。FDA受理Karyopharm公司SINE抑制剂Xpovio(selinexor)的新适应症上市申请,用于治疗经治的多发性骨髓瘤(MM)患者。FDA预计于2021年第一季度末作出审查决定。在一项III期BOSTON研究中,与硼替佐米联合地塞米松方案(Vd)相比,Xpovio联合Vd方案使患者无进展生存期增加4.47个月、增幅达47%(中位PFS:13.93个月vs 9.46个月),将疾病进展或死亡风险降低30%(HR=0.70,p=0.0066);而且显著提高总缓解率;临床中没有新的安全信号出现。
2.Orphazym热休克反应诱导剂arimoclomol在美申请上市。Orphazyme公司已向FDA滚动提交了小分子热休克应激反应诱导剂arimoclomol的新药申请,用于治疗C型尼曼-匹克病(NPC)。在一项关键II/III期临床CT-ORZY-NPC-002中,arimoclomol在稳定NPC神经系统进展方面具有积极作用,特别是≥4岁患者亚组以及接受麦格司他作为常规临床护理的患者亚组;2年治疗期间,arimoclomol显示出对疾病进展的持续改善;此外,当安慰剂组患者转向arimoclomol治疗后,病情进展减少了90%。如果获批,arimoclomol将成为美国首个治疗NPC的药物。
3.牛津大学/阿斯利康新冠疫苗Ⅰ/Ⅱ期临床结果发表。牛津大学与阿斯利康合作开发的新冠病毒候选疫苗ChAdOx1 nCoV-19Ⅰ/Ⅱ期临床COV001中期结果发布在《柳叶刀》上。1077名志愿者接受单剂ChAdOx1 nCoV-19或脑膜炎球菌结合疫苗MenACWY接种,有10名志愿者采用了两剂疫苗接种方案。结果表明,在接种后1个月,单剂和两剂疫苗组产生中和抗体的志愿者比例分别为91%和100%,且中和抗体水平与COVID-19康复期患者相当。ChAdOx1 nCoV-19组出现一次性局部和全身反应,与既往试验和其他腺病毒载体疫苗相当,试验未报告严重不良事件。
4.吸入式干扰素治疗COVID-19早期患者结果积极。英国Synairgen公司吸入式beta干扰素制剂SNG001治疗中度COVID-19患者Ⅱ期临床结果积极。与安慰剂相比,SNG001将患者在治疗期间(第1天至第16天)发生严重疾病(如需要通气或导致死亡)的风险显著降低79%(OR=0.21;95%CI:0.04-0.97;p=0.046);SNG001组患者康复的可能性(无活动限制或没有临床或病毒学证据)是安慰剂组两倍以上(HR=2.19;95%CI:1.03-4.69;p=0.043);而且,SNG001显著降低患者呼吸困难程度。治疗期间,安慰剂组中有3例(6%)患者死亡,SNG001组为0。
5.强生AAV-RPGR治疗X连锁视网膜色素变性新进展。强生旗下杨森在ASRS 2020年会上公布其在研基因疗法AAV-RPGR治疗遗传性视网膜疾病X连锁视网膜色素变性(XLRP)的I/II期试验MGT009(NCT03252847)的中期结果。在剂量递增阶段,治疗6个月时,低剂量和中剂量的AAV-RPGR耐受性良好,并且这两组患者均显示治疗后视网膜敏感性较基线有显著改善。其中,中剂量组的治疗眼和未治疗眼的平均视网膜敏感性差异为1.02dB(90%CI:0.75,1.31)。临床中,疗效信号显示出持续的改善。
6.GSK携手CureVac开发mRNA疫苗。葛兰素史克与CureVac将共同开发、商业化多达5种针对传染性疾病病原体的mRNA疫苗以及单克隆抗体。根据协议,GSK将对CureVac进行1.3亿英镑的股权投资,并支付1.04亿英镑预付款和2600万英镑成本费;CureVac有资格获得高达2.77亿英镑的开发和监管里程碑付款,高达3.29亿英镑的商业里程碑付款以及产品的销售分成;CureVac将负责项目的临床前研发及Ⅰ期临床试验,GSK则负责后续研发与商业化工作;CureVac负责所有产品的生产,并保留所有产品在指定区域的商业化权利。
医药热点
1.北京中高风险地区全清零。7月20日0时至24时,北京无新增报告本地确诊病例、疑似病例和无症状感染者,治愈出院病例12例;无新增报告境外输入确诊病例、疑似病例和无症状感染者。6月11日0时至7月20日24时,北京累计报告本地确诊病例335例,在院104例,治愈出院231例。尚在观察的无症状感染者12例。北京已连续15天无新增报告确诊病例,全市所有街乡均为低风险地区。
2.国办:将符合条件的互联网医疗服务纳入医保。7月21日,国务院办公厅印发《国务院办公厅关于进一步优化营商环境更好服务市场主体的实施意见》,提出6个方面共20条具体措施。其中,意见第十二条中明确提到:在保证医疗安全和质量前提下,进一步放宽互联网诊疗范围,将符合条件的互联网医疗服务纳入医保报销范围,制定公布全国统一的互联网医疗审批标准,加快创新型医疗器械审评审批并推进临床应用。
3.新一轮集采86个药品启动信息采集。7月21日,上海阳光医药采购网发布《关于开展部分药品相关基础信息采集工作的通知》,通知指出,为做好药品集中采购相关工作,优化工作流程,开展部分药品基础信息采集工作。通知显示,此次药品基础信息采集范围包括56个通用名药品(涉及64个品种,86个品规)。据悉,56个通用名药品在2019年中国公立医疗机构终端合计销售额超过500亿元,其中缬沙坦、二甲双胍、卡培他滨等23个药品销售额超过10亿元。
股市资讯
【千红制药】公司与控股子公司众红生物联合申请的一类新药ZHB206注射液获国家药监局颁发的开展急性缺血性脑卒中的I期临床试验通知书,该注射液相关核心技术目前已申请PCT专利和中国发明专利。
【康惠制药】公司拟以自有资金5,040万元向科莱维药业进行增资,增资后将持有科莱维药业18%的股权。
【中源协和】非公开发行限售股2,719.35万股将于2020年7月27日上市流通。
审评动向
1. CDE最新受理情况(07月21日)
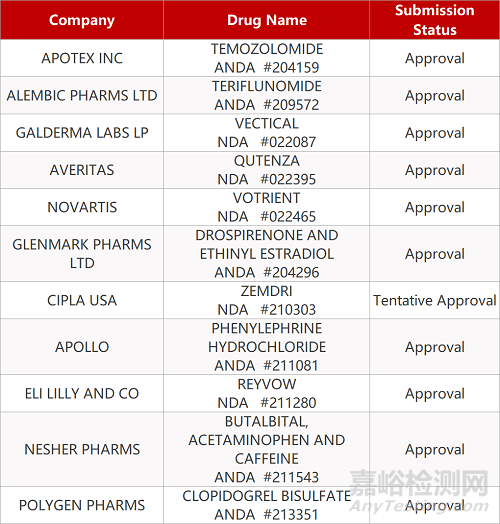
2. FDA最新获批情况(北美07月18日)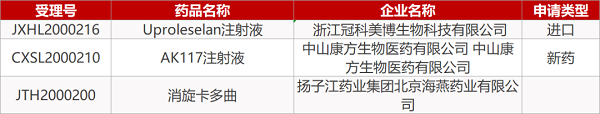
- The End -

来源:药研发


