您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-08-11 21:21
摘 要: 建立一种基于分光光度法和快速图像比色法双模式测定碱性磷酸酶的分析方法。以四甲基联苯胺(TMB)和邻菲啰啉(Phen)为显色探针,在650 nm处测定样品溶液的吸光度,以碱性磷酸酶浓度和吸光度绘制标准曲线。同时以氧化型TMB蓝色的褪去及Fe3+和Phen配合物橙红色的增强两种颜色变化对应的图像RGB变化值对碱性磷酸酶浓度绘制标准曲线。在最佳条件下,吸光度和颜色强度均与碱性磷酸酶浓度在5~100 U/L范围内呈现良好的线性关系,相关系数分别为0.97、0.992,检出限分别为0.35 U/L和5.5 U/L。吸收光谱法样品加标回收率为99.19%~102.72%,测定结果的相对标准偏差为1.31%~4.01% (n=5);图像快速比色法样品加标回收率为96.41%~105.2%,测定结果的相对标准偏差为1.81%~3.09% (n=5)。该方法满足碱性磷酸酶现场快速检测需要。
关键词: 碱性磷酸酶; 抗坏血酸; Fe(Ⅲ); 3,3',5,5'-四甲基联苯胺; 邻菲啰啉; 智能手机比色
碱性磷酸酶(ALP)广泛存在于哺乳动物的骨骼、肝脏、肠黏膜及淋巴等组织和器官中,可催化蛋白质、核酸及小分子中多种磷酸酯的水解和去磷酸化。作为磷酸盐代谢中的重要水解酶,人体血清中ALP水平异常与多种疾病包括骨骼疾病、糖尿病、肝功能不全和癌症等密切相关[1‒3];此外,ALP常被用作酶联免疫实验中的标记酶,用于产生和放大检测信号[4‒6],因此,建立简单、灵敏、准确检测ALP活性的分析方法对临床诊断和生化分析都具有重要意义。目前检测ALP的方法较多,主要有高效液相色谱法[7]、电化学法[8‒9]、电化学发光[10]、吸收光谱法[11‒12]、荧光法[13‒15]等。其中,基于可见光吸收光谱和溶液颜色变化的可视化检测法又称目视比色法,它是一种通过对比或确定有色物质溶液的颜色深浅来测定待测组分含量的方法[16‒17],该法可进一步结合智能手机用于现场快速检测,非常适合仪器配置不足或经济相对落后地区的现场分析。笔者以3,3',5,5'-四甲基联苯胺(TMB)和1,10-菲罗啉(Phen)为显色探针,构建了以Fe3+-TMB-Phen为显色液检测抗坏血酸和碱性磷酸酶活力的比色法。在Fe3+-TMB-Phen显色液中加入ALP,可促使显色液蓝色褪去和橙红色增强两种颜色的变化,以及在650 nm处的吸收峰呈规律下降,可基于吸光度和颜色色度两种模式对ALP进行定量。这种基于两种信号对比获得的检测结果,大大提高了检测结果的准确性和抗干扰能力。
1 实验部分
1.1 主要仪器与试剂
紫外-可见分光光度计:UV-6000T型,上海元析仪器有限公司。智能手机:vivo x90型,预装CS扫描全能王应用软件,维沃移动通信有限公司。电子天平:AE240型,感量为0.01 mg,瑞士梅特勒-托利多公司。L-抗坏血酸钠盐(AA)、3,3',5,5'-四甲基联苯胺、多巴胺、L-去甲肾上腺素、5-五羟色胺:均为分析纯,西格玛奥德里奇公司。L-抗坏血酸-2-磷酸盐(AA-P)、邻菲啰啉(1,10-菲罗啉)、邻苯二酚、对苯二酚,尿酸、其他氨基酸:均为分析纯,上海阿拉丁试剂公司。碱性磷酸酶(ALP,来源于小牛肠)、胰蛋白酶、溶解酵素和其他蛋白质、胎牛血清:中美生物技术有限公司。实验用水为超纯水。
1.2 溶液配制
HEPES缓冲溶液:20 mmol/L,取HEPES (2-[4-(2-羟乙基)-1-哌嗪基]-乙磺酸) 47.60 mg,精密称定,加入超纯水溶解,用盐酸和NaOH溶液调pH值至8.5,将溶液转移至10 mL容量瓶中,加水稀释定容至标线,摇匀。NaAc-HAc缓冲溶液:20 mmol/L,取NaAc 16.40 mg,精密称定,加入超纯水溶解,用盐酸和NaOH溶液调节pH值至4.0,将溶液转移至10 mL容量瓶中,加水稀释定容至标线,摇匀。AA标准储备液:1×10-2 mol/L,取AA 19.81 mg,精密称定,加入HEPES缓冲溶液10 mL溶解,将溶液转移至10 mL容量瓶中,加水稀释并定容至标线,摇匀。现用现配。AA-P标准储备液:1×10-2 mol/L,取AA-P 30.00 mg,精密称定,加入HEPES缓冲溶液10 mL 溶解,将溶液转移至10 mL 容量瓶中,加水稀释并定容至标线,摇匀。现用现配。AA和AA-P系列标准溶液:精密量取AA或AA-P标准储备液1、0.1、0.01 mL,分别置于10 mL 容量瓶中,用HEPES缓冲溶液稀释并定容至标线,摇匀,得到浓度分别为10-3、10-4、10-5 mol/L的系列标准溶液。Fe3+溶液、TMB溶液、Phen溶液:浓度均为1×10-2 mol/L,溶剂均为NaAc-HAc 缓冲溶液,配制方法同AA标准储备液,现用现配。ALP标准溶液:5 000 U/L,用超纯水溶解50 U ALP,将溶液转移至10 mL容量瓶中,加水稀释并定容至标线,摇匀。ALP系列标准溶液:精密量取ALP标准溶液1、0.1、0.01 mL,分别置于10 mL容量瓶中,用HEPES缓冲溶液稀释并定容至标线,摇匀,得到浓度分别为500、50、5 U/L的系列标准溶液。
1.3 样品测定
1.3.1 分光光度法
依次向1.5 mL离心管中加入一定体积的NaAc-HAc缓冲液、Fe3+溶液、TMB溶液和Phen溶液,混匀反应,待混合液显色稳定后,再加入一定体积的AA溶液,或AA-P溶液或其他干扰物溶液,使混合液最终总体积为500 μL,此时Fe3+、TMB和Phen的浓度分别为0.8、1、0.44 mmol/L,待显色稳定后,用手机相机拍照记录溶液颜色,同时在650 nm波长处测定溶液的吸光度,得到紫外-可见吸收光谱。
将10 μL不同活力单位的ALP溶液加入到300 μmol/L AA-P溶液中,在37 ℃下温育10 min,将上述混合液加入到Fe3+-TMB-Phen显色液中,室温下温育,待显色稳定后,记录溶液的颜色变化和吸收光谱。
1.3.2 图像RGB值快速比色法
将显色样品溶液置于台灯下方,台灯高度为29.7 cm,使用手机软件CS扫描全能王进行扫描,每次仅需拖动边框确定扫描区域,即可获得和扫描仪类似效果,故拍照距离对测定结果无影响。使用Adobe Photoshop图像处理软件中的颜色分析功能,在显色区选择5个相同大小的区域,读取RGB 中蓝色通道(即红、绿、蓝中蓝色通道)的显示图像亮度值,基于颜色强度△R+△G与不同浓度的ALP依赖关系定量ALP。
2 结果与讨论
2.1 Fe3+-TMB-Phen显色体系用于检测AA和ALP的可行性分析
以Fe3+为氧化剂,将无色的TMB氧化生成蓝色的oxTMB,oxTMB在650 nm处有最大吸收峰。将一定浓度的Phen加入到Fe3+-TMB显色液中,溶液转为墨绿色。在加入还原性物质(如ALP催化产物AA)后,Fe3+被还原为Fe2+,Fe2+自发与Phen反应生成Fe2+-Phen橙红色配合物,oxTMB被还原性物质还原,导致混合液墨绿色褪去,橙红色增强。还原性物质的加入促使650 nm处的吸光度呈规律下降,产生的Fe2+-Phen橙红色配合物在510 nm处有最大吸光度,但其吸光度不随还原性物质浓度的增大呈规律变化,因此,可通过墨绿色的褪去和橙红色的出现两种颜色的变化,以及650 nm处的吸光度下降值定量还原性物质。基于此,建立一种组成为Fe3+-TMB-Phen的双探针显色体系,用于检测ALP浓度。
如图1所示,向Fe3+-TMB-Phen显色液中加入ALP催化产物AA,随着AA浓度的增加,混合液墨绿色褪去,橙红色出现(图1a),在650 nm处的吸光度随AA浓度升高成比例降低(图1b)。AA浓度在5~200 μmol/L范围内与吸光度具有良好的线性关系,线性方程为A650=0.070 53cAA+0.003 72,相关系数R=0.994。检出限为1.4 μmol/L。如图2所示,向该显色体系加入ALP催化底物AA-P,随着AA-P浓度的增加,混合液颜色和650 nm处的吸光度未发生变化。以上结果表明,酶底物AA-P和产物AA加入到Fe3+-TMB-Phen显色液中会产生不同的吸收响应和颜色变化,可通过检测ALP催化产物AA来定量ALP浓度。
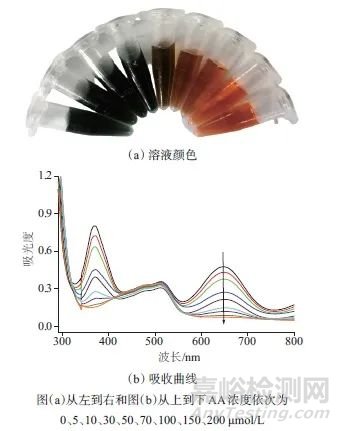
图1 加入不同浓度AA的Fe3+-TMB-Phen显色溶液的颜色和吸收曲线
Fig. 1 Colors and UV-Vis absorption curves of Fe3+-TMB-Phen colorimetric solutions with different concentrations of AA added
图(a)从左到右和图(b)从上到下AA浓度依次为0、5、10、30、50、70、100、150、200 μmol/L
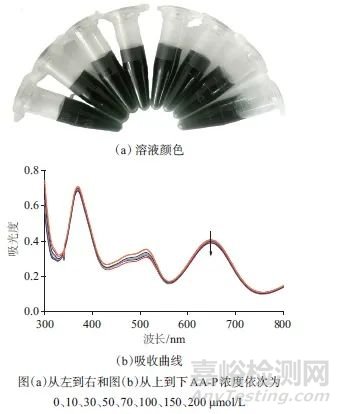
图2 加入不同浓度AA-P的Fe3+-TMB-Phen显色溶液的
Fig. 2 Colors and UV-Vis absorption curves of Fe3+-TMB-Phen colorimetric solutions with different concentrations of AA-P added
图(a)从左到右和图(b)从上到下AA-P浓度依次为 ;颜色和吸收曲线
0、10、30、50、70、100、150、200 μmol/L
2.2 实验条件优化
根据之前的研究经验,优化了以下测定条件:Fe3+-TMB-Phen显色液的底液为20 mmol/L NaAc-HAc 缓冲液(pH 4.0),Fe3+浓度为0.8 mmol/L,TMB浓度为1 mmol/L。在此基础上,为提高Fe3+-TMB-Phen混合液检测AA和ALP的灵敏度,分别对Phen浓度、ALP催化反应底液的pH值和反应时间进行了优化。
在Fe3+-TMB溶液中加入不同浓度的Phen,观察溶液颜色变化,结果如图3a所示。由图3a可以看出,随着Phen浓度的增加,混合液颜色从蓝色逐渐转变为绿色,最终变为墨绿色。当Phen浓度超过250 μmol/L时,混合液颜色保持为墨绿色,即当Phen浓度超过250 μmol/L时,混合液的颜色达到饱和。在上述溶液中加入100 μmol/L AA后,含440 μmol/L Phen的混合液颜色从墨绿色变为橙红色最为明显(如图3b所示)。由于Fe3+-TMB-Phen显色液是基于颜色的变化来定量ALP,因此确定Phen的浓度为440 μmol/L。
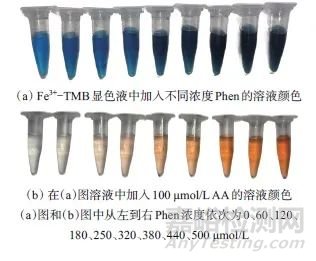
图3 不同Phen浓度时的溶液颜色
Fig. 3 Color of solutions with different concentrations of Phen
(a)图和(b)图中从左到右Phen浓度依次为0、60、120、180、250、320、380、440、500 μmol/L
为筛选ALP催化反应底液的最佳pH值和最佳缓冲液,选取pH 5~pH 10的不同缓冲液(磷酸缓冲液,HEPES缓冲液,Tris-HCl缓冲液)为底液。结果表明,以pH值分别为6、7、8.5的HEPES缓冲液为底液时,体系颜色变化明显;通过对比吸收光谱,当pH 8.5时吸光度下降最大,响应值也最大,因此,选择pH 8.5的HEPES缓冲液为ALP催化反应的底液。
进一步对反应时间进行了优化,试验结果如图4所示。当Fe3+-TMB-Phen三者混合反应3 min时,溶液颜色和650 nm处的吸光度趋于稳定;向Fe3+-TMB-Phen混合液中加入AA,反应5 min溶液颜色和吸光度趋于稳定;ALP催化底物AA-P反应10 min,即在37 ℃下温育10 min,将ALP和AA-P的混合液加入到Fe3+-TMB-Phen显色液中,反应5 min,溶液颜色和吸光度趋于稳定。由于该显色体系具有较好的稳定性,一旦溶液颜色和吸光度稳定后,2 h内几乎不发生变化,所以选择ALP催化反应时间为10 min,其他每步反应均在混合反应10 min时记录试验数据。
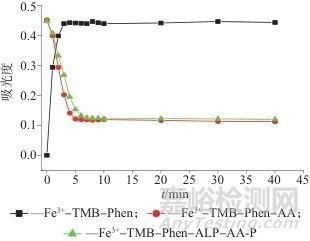
图4 不同反应时间时的吸光度Fig. 4 Absorbance at different reaction times
2.3 专属性
为考察以Fe3+-TMB-Phen显色液检测ALP催化产物AA的专属性,在相同试验条件下,分别将其他生理活性物质(包括尿酸、去甲肾上腺素、多巴胺、葡萄糖、乳酸、5-羟色胺、谷氨酸、邻苯二酚、间苯二酚、对苯二酚、牛血清白蛋白、组氨酸、谷氨酰胺、还原型谷胱甘肽、半胱氨酸等氨基酸)加入到Fe3+-TMB-Phen显色液中,观察溶液颜色和650 nm处的吸光度变化。结果表明,除5-羟色胺外,加入其他生理活性物质,Fe3+-TMB-Phen混合液颜色几乎未发生变化,650 nm处的吸光度略微下降,这一结果说明其他生理活性物质不干扰AA的检测。如图5所示,向该显色体系加入5-羟色胺,随着5-羟色胺浓度的增加,Fe3+-TMB-Phen混合液蓝色略微褪去,650 nm处的吸光度略微下降。由于200 μmol/L 5-羟色胺才能使Fe3+-TMB-Phen混合液在650 nm处的吸光度下降0.12,所以5-羟色胺对AA及ALP检测不构成干扰。
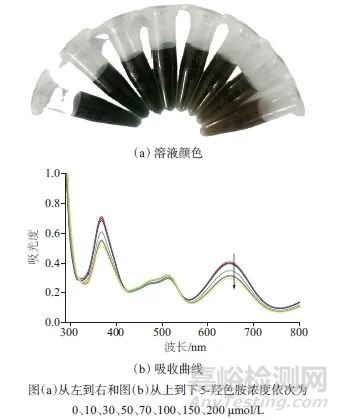
图5 加入不同浓度5-羟色胺时Fe3+-TMB-Phen显色溶液的
Fig. 5 Colors and UV-Vis absorption curves of Fe3+-TMB-Phen colorimetric solutions with different concentrations of 5-serotonin added
图(a)从左到右和图(b)从上到下5-羟色胺浓度依次为 ;颜色和吸收曲线
0、10、30、50、70、100、150、200 μmol/L
为考察以Fe3+-TMB-Phen显色液检测ALP的专属性,在相同实验条件下,分别将其他蛋白质和酶(包括葡萄糖氧化酶、溶菌酶、胰蛋白酶、乙酰胆碱酯酶,浓度均为200 U/L;白蛋白、牛血清白蛋白,浓度为0.1 mg/mL)与AA-P混合后加入到Fe3+-TMB-Phen混合液中。结果表明,加入上述蛋白质和酶后混合溶液在650 nm处的吸光度变化可忽略不计,且混合溶液未发生明显的颜色变化,表明Fe3+-TMB-Phen显色液对ALP的测定具有较好的专属性。
2.4 线性方程与检出限
按照1.3方法对ALP系列标准溶液进行测定,以ALP浓度为横坐标(x),以650 nm处的吸光度为纵坐标(y),绘制标准工作曲线,计算得线性回归方程y=0.002 52x+0.083 92,相关系数r=0.97。表明ALP浓度在5~100 U/L范围内与吸光度具有良好的线性关系。按照1.3方法对空白溶液平行测定10次,计算标准偏差,以3倍标准偏差与标准工作曲线斜率的比值为检出限,得检出限为0.35 U/L。与我们之前建立的单探针Fe3+-TMB显色体系相比(检出限为0.05 U/L),Fe3+-TMB-Phen显色体系的检出限相对较高,但是,Fe3+-TMB-Phen显色体系可以避免大部分其他还原性物质(如还原型谷胱甘肽、多巴胺和尿酸等)对AA和ALP检测的干扰,相较Fe3+-TMB体系具有更高的选择性。
ALP加入到Fe3+-TMB-Phen显色体系中呈现墨绿色褪去和橙红色出现两种颜色的变化,按照1.3方法对ALP系列标准溶液进行测定,以ALP浓度为横坐标(x),以RGB中(△R+△G)值为纵坐标(y)绘制标准工作曲线,计算得线性回归方程y=1.279x+3.215 2,相关系数r=0.992。表明ALP浓度在5~100 U/L范围内与吸光度具有良好的线性关系。当颜色差异裸眼可区别,即(△R+△G)值大于空白值10时为检测限,酶的检出限为5.5 U/L。上述结果表明,所建立的双探针比色法可通过吸光度和颜色RGB定量ALP活力。
2.5 样品加标回收试验
用HEPES缓冲溶液将胎牛血清稀释至10倍体积。将不同浓度的ALP溶液分别加入胎牛血清稀释液中,配制成不同活力单位的ALP加标血清样品溶液,每个加标水平平行制备5份样品溶液。将10 μL 不同活力单位的ALP加标血清样品溶液加入到300 μmol/L AA-P溶液中,在37 ℃下温育10 min,将上述混合液加入到Fe3+-TMB-Phen显色液中,室温下温育,待显色稳定后,记录反应溶液的颜色变化并测定吸光度。分别采用分光光度计和图像RGB值快速比色法对ALP加标样品溶液进行检测,以验证方法的准确性,结果见表1。
表1 样品加标回收试验结果
Tab. 1 Results of samples spiked recovery testr
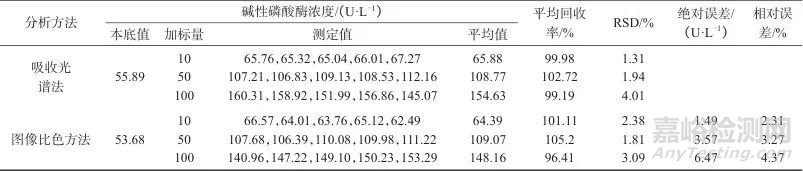
由表1可知,吸收光谱法样品加标回收率为99.19%~102.72%,图像快速比色法样品加标回收率为96.41%~105.2%,表明两种检测模式均具有较高的准确度。将两种模式的检测结果进行对比,检测结果绝对误差不超过6.47 U/L,相对误差不超过4.37%,表明快速图像比色法的测定结果与吸收光谱法相比基本一致。两种检测模式的相对标准偏差均不大于4.01%,表明基于Fe3+-TMB-Phen显色体系的两种检测模式均具有较高的精密度。
3 结语
建立了一种基于分光光度法和快速图像比色法双模式测定碱性磷酸酶活力。以四甲基联苯胺和邻菲啰啉为显色探针,基于碱性磷酸酶的底物2-磷酸抗坏血酸与水解产物抗坏血酸不同的还原性,以650 nm处的吸光度变化和两种颜色对应的图像RGB变化值对碱性磷酸酶浓度进行检测,检测结果灵敏度高,精密度好,准确度满足分析要求。该方法简单、快速,基于两种信号对比获得检测结果,大大地提高了检测的准确性和抗干扰能力,适用于碱性磷酸酶现场快速检测。
参考文献
1 JIANG Chengying,HU Fangke,LI Jiazhen,et al. Diagnostic value of alkaline phosphatase and bone-specific alkaline phosphatase for metastases in breast cancer:a systematic review and meta-analysis[J]. Breast Cancer Research and Treatment,2023,202(2): 233.
2 YAGI N,SUZUKI S,ARITA T,et al. Association between serum alkaline phosphatase and cardiovascular events in patients with atrial fibrillation[J]. Heart and Vessels,2023,38(2): 236.
3 MISRA M K,SINGH A,VERMA A,et al. Study of C-Reactive protein and alkaline phosphatase among Type 2 diabetes mellitus patients[J]. Journal of Cardiovascular Disease Research,2023,14(2): 684.
4 WEN Li,HUANG Yirui,SUN Zhichang,et al. Development of alkaline phosphatase-linked single-chain variable fragment fusion proteins for one-step immunodetection of deoxynivalenol in cereals[J]. Analytical and Bioanalytical Chemistry,2024,416(12): 2 929.
5 ZHOU Tijian,LI Li,ZHU Zhirong,et al. Serum-based detection of liver pathology using a fluorogenic alkaline phosphatase probe[J]. ChemBioChem,2023,24(18): 1.
6 SHANG Cuiling,LI Yansong,QI ZhangShang,et al. Alkaline phosphatase-triggered dual-signal immunoassay for colorimetric and electrochemical detection of zearalenone in cornmeal[J]. Sensors and Actuators,B. Chemical,2022: 358: 131 525.
7 HIROSE A,ESAKA Y,OHTA M,et al. On-line HPLC determination of enzymatic activity of alkaline phosphatase in natural water using spectrofluorometric detection[J]. Chemistry Letters,1993(2): 307.
8 MARÍA J S E,SALMA H K,DAVID S T,et al. Design of an electrochemical device for the detection of alkaline phosphatase inhibitors in seawater[J]. ChemElectroChem,2024,11(16):e202400271.
9 余婷婷,王敏,文颖,等.基于金纳米线构建电化学传感器间接检测碱性磷酸酶活性[J].上海师范大学学报(自然科学版),2022,51(5): 582.
YU Tingting,WANG Min,WEN Ying,et al. Indirect detection of alkaline phosphatase activity by electrochemical sensor based on gold nanowires[J]. Journal of Shanghai Normal University(Natural Sciences),2022,51(5): 582.
10 ZHANG Yu,CAO Xia,WANG Zhuoran,et al. Enhanced bipolar electrode electrochemiluminescence biosensor for ultrasensitive monitoring of alkaline phosphatase activity during osteoblast differentiation by integrating electrocatalytic and enzymatic strategies[J]. Sensors and Actuators:B. Chemical,2025,423: 136 823.
11 XUE Liuheng,WANG Gang,LIU Jia,et al. MoO2 and N-doped carbon nano-octahedron nanozymes for sensitive detection of alkaline phosphatase[J]. ACS Applied Nano Materials,2023,6(9): 7 775.
12 CHANG Yangyang,ZHANG Qian,XUE Wei,et al. Self-assembly of protein-DNA superstructures for alkaline phosphatase detection in blood[J]. Chemical Communications,2023,59(23): 3 399.
13 ZHANG Yiming,DING Yinghao,LI Xinxin,et al. Enzyme-instructed self-assembly enabled fluorescence light-up for alkaline phosphatase detection[J]. Talanta,2022,239: 123 078.
14 贾宝珠,何镇熹,黄心洳,等.基于碳点内滤效应快速检测鲜牛奶中碱性磷酸酶活性的荧光分析方法的构建[J].食品工业科技,2023,44(17): 334.
JIA Baozhu,HE Zhenxi,HUANG Xinru,et al. Development of a fluorescence assay for rapid detection of alkaline phosphatase activity in fresh milk based on inner filter effect of carbon dots[J]. Science and Technology of Food Industry,2023,44(17): 334.
15 ZHANG Shengyuan,YANG Ying,YANG Dezhi,et al. MOF-mediated cascade reaction system for ultrasensitive detection of alkaline phosphatase activity and organophosphorus pesticides[J]. Microchimica Acta,2024,191(11): 1.
16 GUO Yubo,ZHU Jian,WENG Guojun,et al. DMSO-mediated Ag lateral coated Au nanobipyramids:ultrafast colormetric detection platform for Fe3+ with uniform etching[J]. Journal of Alloys and Compounds,2024,992: 174 572.
17 陈喆,高文分,刘屹.快速显色法筛查祛斑美白类化妆品中糖皮质激素[J].化学分析计量,2024,33(7): 7.
CHEN Zhe,GAO Wenfen,LIU Yi. Rapid colorimetric screening of glucocorticoids in freckle removal and whitening cosmetics[J]. Chemical Analysis and Meterage,2024,33(7): 7.

来源:化学分析计量


