您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-04-17 10:00
过程确认到底需要多少样本量这个问题一直困扰着广大医疗器械制造商。今天主要和大家讨论一些基本的概念,从法规背景、过程确认样本量决定的原理、数据类型、置信度和可靠性、AQL水平这五个方面来和大家介绍。
ISO 13485:2016条款7.5.6 生产和服务提供过程的确认 d)提到 应适当地采用具有样本量依据的统计技术。
FDA QSR 820的条款 820.250提到 在适当的情况下,每个制造商应建立并维护用于确定建立、控制和验证制程能力和产品特性可接受性的合理的统计技术。使用时,应制定基于有效的统计依据的抽样计划。
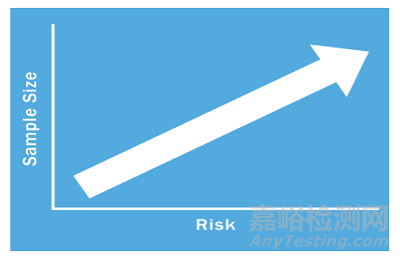
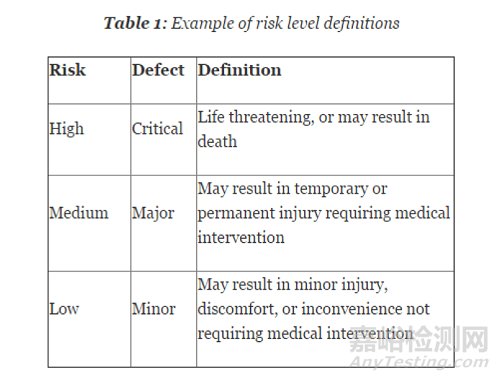
那么样本量决定要基于什么原理呢?我们都知道医疗器械的监管要求是和医疗器械的风险相适应的。风险低的产品监管要求也比较低,风险高的产品监管要求就比较高。样本量确定也遵循同样的原理。你要去考虑过程失效造成的风险有多大,风险越大该过程确认所需的样本量就越大(请见下图)。
在正式讨论如何确定样本量之前我们还要考虑过程确认时涉及到的参数的数据类型。数据类型分为两类,分别是:
变量(Variable)参数:比如长度,重量,强度等等
属性(Attribute)参数:比如好/坏,通过/失败
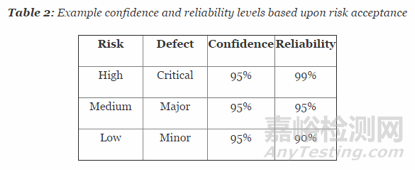
样本量的确定可以考虑采用置信度和可靠性的方法。在采用该方法之前我们要先弄清楚置信度和可靠性的定义。
置信度:预计的可能性的不确定度
可靠性:特定时间内和特定情况下产品正常工作的可能性
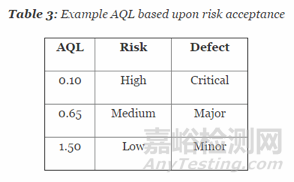
样本量的确定还可以采用AQL水平的方法。什么叫AQL水平呢?AQL的全称是Acceptable quality level, 接收质量限。即当一个连续系列批被提交验收时,可允许的最差过程平均质量水平。

来源:启升资讯


