您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-15 10:28
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
连花清瘟胶囊获批新冠适应症。以岭药业收到国家药监局下发的《药品补充申请批件》,批准连花清瘟胶囊处方药说明书中【功能主治】【用法用量】项的修订申请。具体修订内容为:连花清瘟胶囊处方药说明书中【功能主治】项除原批准内容外,增加“在新型冠状病毒肺炎的常规治疗中,可用于轻型、普通型引起的发热、咳嗽、乏力。”,【用法用量】项除原批准内容外,增加“新型冠状病毒肺炎轻型、普通型疗程7-10天。”
1. 珍视明4类新药玻璃酸钠滴眼液获批上市。4月10日,珍视明药业申报的新4类玻璃酸钠滴眼液获得国家药监局批准,视同通过一致性评价。这是国内继普什制药之后第2家该品种通过一致性评价的企业。玻璃酸钠滴眼液为眼科市场的主要品种,用于干眼症,缓解干眼症状。目前,国内拥有该产品生产批文的国产企业有齐鲁制药、扬子江药业、兴齐眼药等15家,进口企业有3家。
2. 百济神州PD-1组合疗法治疗非小细胞肺癌临床达终点。百济神州抗PD-1抗体百泽安®(替雷利珠单抗注射液)联合培美曲塞及铂类化疗一线治疗非鳞状非小细胞肺癌(NSCLC)的Ⅲ期临床NCT03663205达主要终点。与培美曲塞联合铂类药物相比,百泽安®联合培美曲塞及铂类化疗显著提高了患者的无进展生存期,该联合用药的安全性数据与每项试验用药的已知风险相符,未出现新的安全警示。百济神州计划近期递交百泽安®该新适应症的上市申请,并在未来的学术会议上分享具体的试验数据。
3. 奥赛康ASKB589注射液临床申请获受理。江苏奥赛康1类治疗用生物制品ASKB589注射液临床试验申请获国家药监局受理。ASKB589注射液是江苏奥赛康自主研发、具有自主知识产权的抗肿瘤生物新药,其主要通过ADCC和补体依赖的细胞毒作用(CDC)杀伤肿瘤细胞,拟用于胃及胃食管结合部腺癌、胰腺癌等适应症。目前国内外尚无同类产品获批上市。奥赛康为该产品已投入研发费用约7,464.39万元人民币。
4. 歌礼HIV蛋白酶抑制剂ASC09F获批临床。歌礼制药抗病毒药物ASC09F(ASC09/利托那韦复方片)临床试验申请获国家药监局批准。ASC09F是一款HIV蛋白酶抑制剂ASC09和利托那韦的复方制剂。ASC09是歌礼的引进品种,具有极高的基因耐药屏障,已完成的Ⅰ期及Ⅱa期临床数据显示,使用ASC09单一治疗两周后,病毒载量降低1.79log(患者血液样本中病毒载量降低 62倍),且安全性和耐受性良好。利托那韦是一种HIV蛋白酶抑制剂,也是一种强效CYP3A4抑制剂。
5. 康方生物拟于4月24日港交所上市。康方生物在香港证券交易所提交全球发售文件,计划于2020年4月24日9点正式在港交所上市交易,拟预计募资23.7亿港元~25.8亿港元(3亿美元以上),发行市值在113.55亿~123.47亿港元之间。康方生物成立于2012年,致力于自主研发新一代创新型抗体药物。目前拥有20多个药物开发项目,包括12个处于临床阶段开发的抗体,6个双特异性抗体(两个处于临床阶段)及4个获得FDA的IND批准的抗体。
1. FDA批准首个COVID-19唾液检测产品。Rutgers研究所旗下RUCDR Infinite Biologics及其合作者获得FDA紧急使用授权(EUA),可进行新型冠状病毒唾液检测。这是首个获得FDA批准用于COVID-19的唾液检测服务,其将比目前的鼻和咽拭子检测方法用于更广泛的人群筛查。据悉,这种新型唾液收集检测方法由RUCDR与Spectrum Solutions和Accurate诊断实验室合作开发。该唾液检测利用了Spectrum DNA的唾液收集和保存试剂盒,检测方法是采用实时逆转录聚合酶链反应检测。
2. 拜耳阿柏西普预充式注射器在欧洲获批。拜耳Eylea(艾力雅®,aflibercept,阿柏西普眼内注射溶液)新的预充式注射器获欧洲药品管理局(EMA)批准,用于治疗5种成人视网膜疾病。与现有的安瓿瓶产品相比,这种新的给药方式使用起来更方便,并且能减少感染的风险。据悉,阿柏西普是获批的唯一一款在临床试验中成功将治疗间隔延长至4个月(16周)的抗VEGF疗法,并且在延长治疗间隔的同时,能维持良好的视力获益,避免视力丧失。
3. 美国开展氯喹/羟氯喹预防新冠临床试验。华盛顿大学医学院开展规模达5.5万人的预防COVID-19临床试验(CROWN CORONATION trial,NCT04333732)。该研究旨在使用氯喹/羟氯喹保护处于感染风险中的医务工作者,防止整个医疗体系的崩溃。这是一项国际多中心的随机、双盲、安慰剂对照临床试验,拟纳入年满18周岁及以上的5.5万名医务工作者。参研医院可自行决定使用羟氯喹或者氯喹。
4. 阿斯利康将启动Calquence新冠项目临床研究。4月14日,阿斯利康宣布将启动一项全球临床试验(CALAVI),在COVID-19感染伴随过度免疫应答(细胞因子风暴)重症患者中评估Calquence联合最佳支持治疗(BSC)与BSC治疗的疗效和安全性。Calquence是新一代高选择性BTK抑制剂,目前获批用于治疗某些类型的血癌(如慢性淋巴细胞白血病、套细胞淋巴瘤)。Calquence的早期临床数据表明,BTK抑制引起的炎症减少似乎可以降低COVID-19诱导的呼吸窘迫严重程度。
5. 吉利德KTE-X19治疗复发/难治性MCL总缓解率达93%。吉利德CAR-T细胞疗法KTE-X19治疗复发或难治性套细胞淋巴瘤(R/R MCL)的注册II期临床研究ZUMA-2(NCT02601313)已在线发表于《新英格兰医学杂志》(NEJM)上。根据独立放射学审查委员会(IRRC)的评估,中位随访12.3个月时,客观缓解率(ORR)为93%(n=56/60,95%CI:84-98)、完全缓解率(CR)为67%(n=40/60,95%CI:53-78)。在12个月时,估计的无进展生存率(PFS)为61%、总生存率(OS)为83%。目前,该药治疗R/R MCL的上市申请正在接受FDA和EMA的审查。
6. Alnylam和Dicerna合作开发罕见肝病RNAi疗法。Alnylam和Dicerna公司联合宣布,双方将就其ALN-AAT02和DCR-A1AT,开展一项治疗与α-1抗胰蛋白酶(A1AT)缺乏症相关肝病(α-1肝病)治疗药物的研发合作。此外,两家公司还为其治疗原发性高草酸尿症(PH)的lumasiran和nedosiran的研究计划达成了各自知识产权的交叉许可。ALN-AAT02和DCR-A1AT是靶向A1AT的皮下注射RNAi疗法,用于治疗与A1AT缺乏症相关的肝病。根据协议,Dicerna将领导DCR-A1AT和ALN-AAT02的全球临床开发和在美国的商业化活动。Alnylam保留了完成Ⅲ期试验后在美国以外地区商业化的权益。
1. 武汉确定211家核酸检测机构。武汉市卫健委发布公告,明确武汉同济医院、武汉协和医院、中部战区总医院等211家医疗机构为新冠病毒核酸检测机构。这211家医疗机构既包括大型三甲综合医院,也包括社区卫生服务中心、乡镇卫生院及部分民营医疗机构,这些医疗机构经武汉市相关区级卫健行政部门备案同意。为满足社会化新冠病毒核酸检测需求,核酸检测结果将及时推送至个人“健康武汉”手机端,武汉市民可自愿或者由单位组织到这些机构进行核酸检测。
2. 雷神山患者清零。4月14日上午,武汉雷神山医院最后4名危重症患者转院至武汉大学中南医院接受后续治疗。至此,雷神山医院运转67天以来,患者清零,消杀后关闭备用。4月13日0时—24时,国内新增确诊病例89例,其中86例为境外输入病例,分别为黑龙江79例,广东6例,福建1例;3例为广东本土病例。湖北当日无新增确诊病例,无新增和现有疑似病例,无新增死亡病例。新增治愈出院病例25例,全部为武汉病例。
3. 对入境人员实行分级分区管理。4月13日,国家卫健委疾控局监察专员在新闻发布会上表示,目前对所有入境人员采取14天集中医学观察政策,并实行精准分类、分级分区的管理策略。其中,对于非“四类”人员(确诊病例、疑似和有发热等症状者、密切接触者或无症状感染者),实施14天集中医学观察,其间可自愿自费接受实验室检测,即在第3天、第5天进行2次核酸检测,同时在第5天进行血清特异性IgM抗体检测,上述3种检测均为阴性,在集中医学观察7天后即可居家再进行7天医学观察。
【以岭药业】(1)公司和全资子公司北京以岭收到国家药品监督管理局下发的连花清瘟胶囊和连花清瘟颗粒的关于新增适应症申请的《药品补充申请批件》,说明书中【功能主治】增加“在新型冠状病毒性肺炎的常规治疗中,可用于轻型、普通型引起的发热、咳嗽、乏力。”。(2)公司股票交易价格于2020年4月10日、4月13日、4月14日连续3个交易日收盘价格涨幅偏离值累计达到24.36%。根据《深圳证券交易所交易规则》的相关规定,属于股票异常波动情况。
【明德生物】2020 Q1归属于上市公司股东的净利润为0万元至482.86万元,比上年同期下降70%至100%。
【华海药业】周明华先生计划自本公告披露之日起15个交易日后的6个月内,拟通过集中竞价方式减持其所持公司股份不超过2,644万股,即不超过公司股份总数的2%。
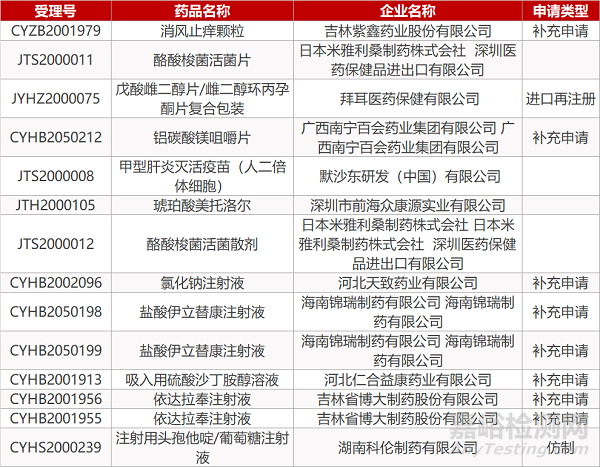
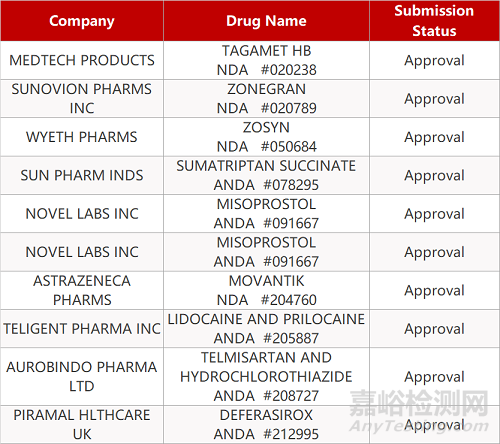
1. CDE最新受理情况(4月14日)
- The End -

来源:药研发


