您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-26 09:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:14条资讯,阅读时长约:3分钟 」
复星凯特CAR-T疗法申报上市。复星凯特宣布,国家药监局已受理其CAR-T细胞治疗产品益基利仑赛注射液(FKC876)的新药上市申请,用于治疗二线或以上系统性治疗后复发/难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。FKC876是复星凯特于2017年从吉利德旗下Kite公司引进YESCARTA(Axicabtagene Ciloleucel)技术、并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品。
1.盛诺基乳腺癌脑转移治疗药物临床结果积极。盛诺基与加拿大AngioChem公司的合作品种ANG1005(SNG1005),在治疗乳腺癌脑转移的Ⅱ期研究中获积极结果。在接受SNG1005治疗的可评估患者中,患者的颅内、颅外临床获益率分别为77%和86%,颅内客观反应率(iORR)为15%(研究者评估)或8%(独立放射学评估);在乳腺癌脑转移同时并发软脑膜癌患者中,SNG1005可延长患者的生存期,中位总生存期为8个月;HER2阳性患者与HER2阴性患者的iORR分别为14%和3%;临床中SNG1005的安全性与普通紫杉醇类似。研究成果在线发表在期刊《临床癌症研究》(Clinical Cancer Research)上。
2.亚盛医药IAP抑制剂Ⅰb/Ⅱ期临床获CDE批准。亚盛医药在研1类新药IAP抑制剂APG-1387获CDE批准,即将在中国开展联合化疗(白蛋白紫杉醇及吉西他滨方案)治疗晚期胰腺癌患者的Ⅰb/Ⅱ期临床研究。值得一提的是,APG-1387是中国首个进入临床阶段的新一代凋亡蛋白抑制因子(IAP)抑制剂。此次在中国获批的这项临床研究是一项多中心、开放性的Ⅰb期剂量探索研究以及Ⅱ期疗效探索研究,旨在评价APG-1387联合化疗治疗晚期胰腺癌的安全性、PK特征及初步的疗效。
3.石药集团抗Connexin43单抗即将在澳大利亚开展临床。2月24日,石药集团公告称,其附属公司AlaMab已获得相关伦理委员会及临床试验机构批准,并收到监管机构的临床试验通知确认函,可在澳大利亚启动在研新药ALMB-0168用于治疗骨癌和癌症骨转移的首次人体临床试验。ALMB-0168是AlaMab公司自主研发的一款针对全新靶点半通道膜蛋白Connexin43的人源化单抗激动剂产品,拟用于治疗骨癌、癌症骨转移及骨质疏松等适应症。据悉,该药物已经获FDA授予的用于治疗骨癌的孤儿药资格和罕见儿童疾病资格。
4.诺华NASH在研药物在华申报临床。诺华旗下非酒精性脂肪性肝炎(NASH) 在研药物tropifexor胶囊在华提交的临床申请获国家药监局受理。Tropifexor是诺华研发的一款法尼醇X受体(FXR)激动剂,在临床试验中,能够剂量依赖性降低患者肝脏脂肪水平,血清转氨酶水平以及患者体重。目前,诺华正与多家药企合作,开发tropifexor单药或组合疗法治疗NASH患者。全球目前已有多款FXR激动剂处于临床研究阶段,进展最快是Intercept公司开发的奥贝胆酸。
1.诺华CD20抗体疗法获优先审评。诺华宣布,FDA和欧洲药管局已受理其人源化CD20抗体Arzerra(ofatumumab,OMB157)的补充生物制品许可申请和营销授权申请,治疗复发型多发性硬化症患者。FDA同时授予其优先审评资格,预计于6月做出回复。如果获批,Arzerra将成为首款患者可以在家中自行使用的自动注射型B细胞疗法。在临床研究(ASCLEPIOS)的两项Ⅲ期试验中,与特立氟胺相比,ofatumumab将患者的年复发率分别降低50.5%和58.8%。此外,ofatumumab还将患者3个月残疾进展(CDP†)的相对风险降低34.4%(p=0.002),6个月后的这一数值为32.5%。
2.武田ALK抑制剂Alunbrig获FDA优先审评。武田(Takeda)下一代酪氨酸激酶抑制剂(TKI)Alunbrig(brigatinib)递交的补充新药上市申请获FDA受理,用于一线治疗ALK阳性非小细胞肺癌(NSCLC)患者。FDA同时授予其优先审评资格。一项Ⅲ期临床ALTA-1L结果显示,根据研究者的评估,Alunbrig治疗组患者的无进展生存期(PFS)为29.4个月,而活性对照组(crizotinib)的PFS为9.2个月。在脑转移瘤患者中,Alunbrig组的PFS为24个月,活性对照组为5.6个月。此前,Alunbrig已获得FDA批准用于治疗ALK阳性转移性NSCLC患者。这些患者在接受crizotinib治疗之后疾病继续进展。
3.GSK尼拉帕利补充新药申请获FDA受理。葛兰素史克(GSK)宣布,FDA已受理其PARP抑制剂尼拉帕利(niraparib,Zejula)的补充新药申请,用于一线维持治疗对铂基化疗产生响应的晚期卵巢癌患者(无需考虑患者的生物标志物状态)。FDA将使用实时肿瘤学审评(RTOR)试点项目对这一申请进行评估。一项临床PRIMA数据表明,无论患者的生物标志物状况如何,Zejula将患者疾病进展或死亡风险降低38%(HR=0.62, 95% CI, 0.50-0.75, p<0.001),Zejula组PFS为13.8个月,对照组为8.2个月。
4.Adrecizumab概念验证II期临床研究成功。近日,Adrenomed AG公司公布了概念性验证AdrenOSS-2 II期临床试验(NCT030857583)的阳性顶线结果。该试验在早期脓毒性休克患者中评估adrecizumab联合标准护理治疗的疗效与安全性。结果显示,该研究达主要终点:adrecizumab显示出良好的安全性,并且耐受性良好。临床中,adrecizumab的安全性和耐受性与先前I期试验中观察到的结果一致。此外,在28天随访中,安慰剂组死亡率为28%,同时观察到adrecizumab治疗组全因死亡率低于安慰剂组的趋势。详细数据将在今年晚些时候在同行评议期刊上发表。
5.新型抗菌疗法获突破性疗法认定。ContraFect公司开发的在研重组溶素(细胞壁水解酶)exebacase(CE-301)获FDA授予突破性疗法认定,用于治疗由耐甲氧西林金黄色葡萄球菌(MRSA)引起的血液感染(菌血症),其中包括右侧心内膜炎患者的治疗。一项Ⅱ期临床结果显示,与标准护理疗法(SOC)相比,exebacase联合SOC可以将患者在第14天的临床缓解率提高42.8%(74.1%vs31.3%)。此外,exebacase的治疗还使患者的30天内全因死亡率降低了21%,患者的住院天数减少4天,显著降低患者住院30天后再入院的几率。
6.Moderna首批新冠肺炎疫苗已生产。2月25日,专注于mRNA药物和疫苗研发的临床阶段的生物技术公司Moderna宣布,已生产出第一批供人体试验使用的新型冠状病毒的疫苗mRNA-1273。mRNA-1273是一种针对新型冠状病毒编码的Spike (S)蛋白预融合稳定形式的mRNA疫苗,由Moderna与NIAID疫苗研究中心(VRC)联合开发。目前该疫苗已被运往美国国立卫生研究院(NIH)下属的美国国家过敏与传染病研究所(NIAID) ,将用于计划中的Ⅰ期临床研究。
1.上海支持“互联网+”医疗服务试行纳入医保支付。2月23日,上海市疫情防控工作领导小组在新闻发布会透露,为全面服务疫情防控和统筹做好日常医疗保障,本市医保部门在前期工作基础上,推出“医保12条”措施:包括支持“互联网+”医疗服务试行纳入医保支付、合理增加医保总额预算管理指标、鼓励医疗机构开展新技术新项目、稳妥实施本市新版医保药品目录、激励家庭医生做好居民签约服务等。
2.江苏恢复日常诊疗秩序。江苏省卫健委近日印发《关于做好新冠肺炎疫情期间医疗服务工作的通知》,要求全省医疗机构做好疫情防控的同时,除了口腔、耳鼻喉、部分眼科等面部诊疗项目外,即日起其他科室逐步恢复正常诊疗秩序。《通知》要求,各医疗机构要严格按要求设置发热门诊,实行预检分诊,对全部来院人员(包括医务人员)检测体温,详细询问发热患者流行病学史,并做好记录。《通知》同时强调,要严格控制门诊候诊区域,执行“一人一诊一室”。
3.我国全面禁止非法交易和食用野生动物。十三届全国人大常委会第十六次会议24日表决通过了关于全面禁止非法野生动物交易、革除滥食野生动物陋习的决定。决定自公布之日起施行。决定规定,凡野生动物保护法和其他有关法律禁止猎捕、交易、运输、食用野生动物的,必须严格禁止。全面禁止食用国家保护的“有重要生态、科学、社会价值的陆生野生动物”以及其他陆生野生动物,包括人工繁育、人工饲养的陆生野生动物。全面禁止以食用为目的猎捕、交易、运输在野外环境自然生长繁殖的陆生野生动物。
【桂林三金】公司全资子公司湖南三金生产的玉叶解毒颗粒被《广西壮族自治区新型冠状病毒肺炎中医药治疗方案(试行第三版)》列为中医药治疗医学观察期和临床治疗期(确诊病例)轻型或普通型湿热蕴肺证的推荐用药。
【舒泰神】2019年度实现营业收入6.61亿元(-17.94%);归母净利润0.27亿元(-79.64%)。
【海思科】公司全资子公司四川海思科拟将眉山分公司所运营的资产及其相关的债权、债务及劳动力以2020年02月21日为基准日按账面净值28,464.38万元划转给其全资子公司眉山海思科。
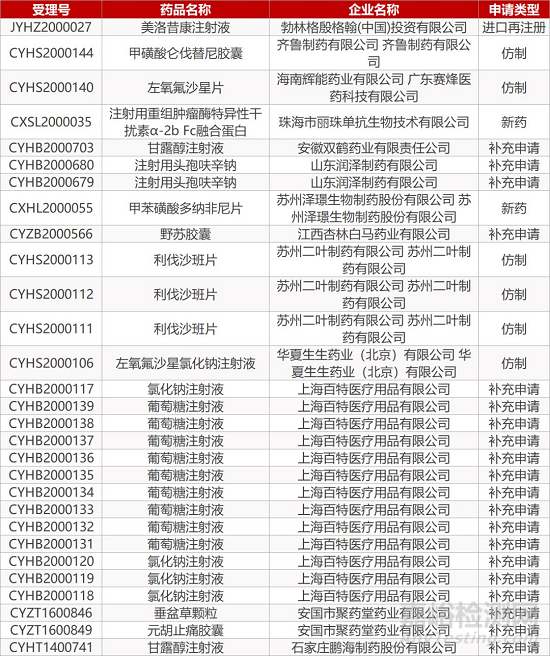
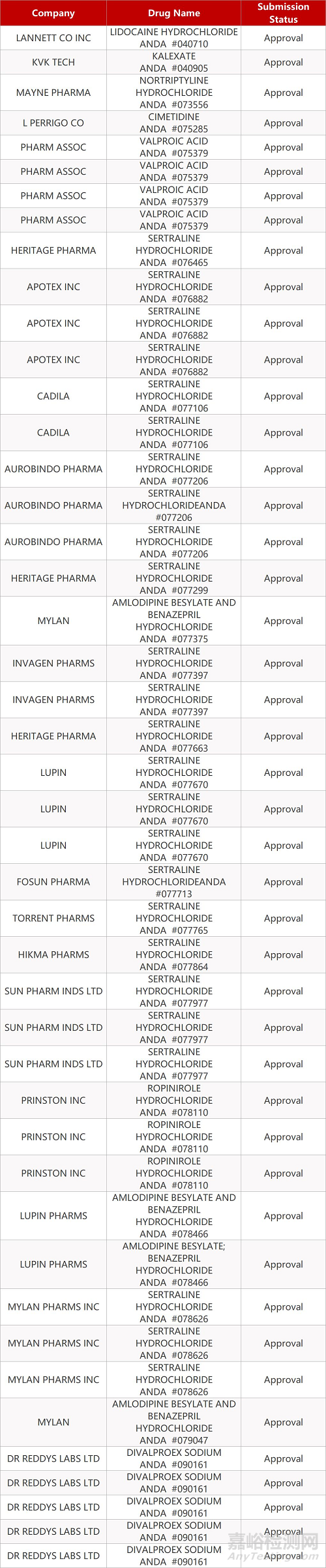
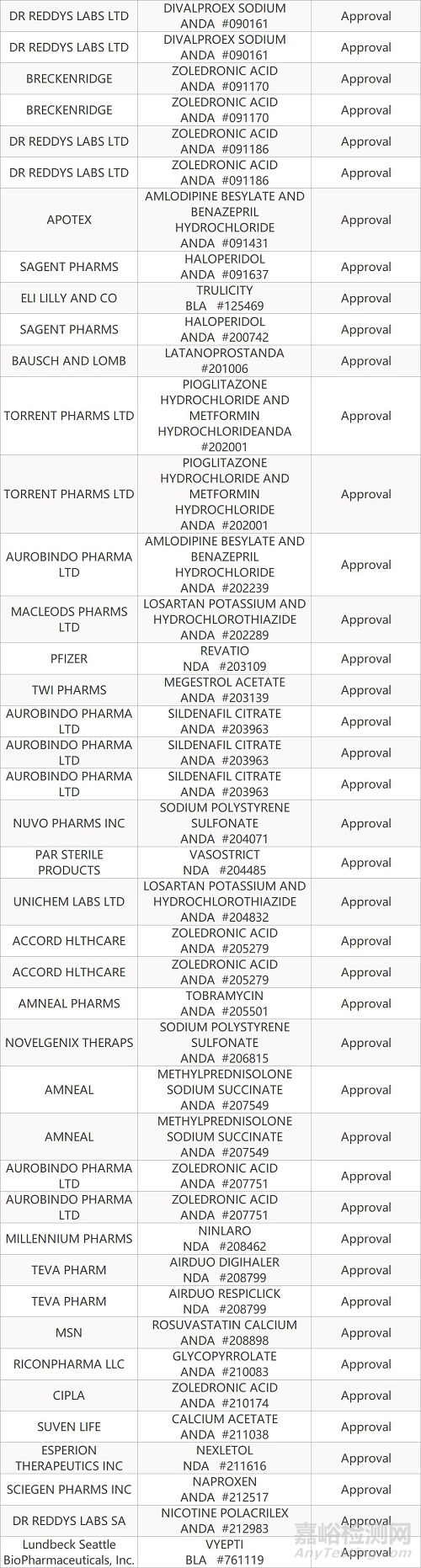
- The End -

来源:药研发


