作者|田洁,常艳艳,龚青,孙桂霞(CDE)
《英国药典》(BP)2017[1]将阴道制剂定义如下:“阴道制剂是指阴道途径给药,通常发挥局部作用的液体、半固体或固体制剂,阴道制剂可以包含一种或多种活性成分。”《中国药典》(Ch.P)2015四部通则[2]收载了阴道片和阴道泡腾片。阴道片和阴道泡腾片的形状应易置于阴道内,可借助器具将阴道片送入阴道。阴道片在阴道内应易溶化、溶散或融化、崩解并释放药物,主要起局部消炎杀菌作用,也可给予性激素类药物。具有局部刺激性的药物,不得制成阴道片。
虽然有少数阴道制剂通过全身作用起效,但多数为局部起效药物。欧盟明确将阴道途径给药纳入局部作用药物范畴[3]。对于全身起效的阴道制剂,因可进行生物等效性研究,其仿制药质量和疗效一致性评价可参照口服固体制剂及具体剂型的相关要求。此处主要对局部作用的阴道制剂仿制药的质量和疗效一致性评价要求进行讨论。
1 阴道制剂批准上市情况
经查询[4-5]( 截止日期2017-12-7) ,FDA批准的已上市阴道途径给药品种17种,主要为抗菌类药物和激素类药物,剂型主要包括:乳膏、栓剂、片剂、凝胶剂和植入剂等。其中2000年后FDA批准的局部作用的阴道制剂有7种,均为仿制药和改处方制剂,未见新化合物(NCE)品种上市,大多为2010年前批准的,有3个2000年前批准的品种(制菌霉素、磺胺和壬苯醇醚-9)未见再批准上市信息。2000~2017年欧洲药学机构负责人(HMA,Heads of Medicines Agencies) 批准24个阴道制剂品种。2004~2017 年日本批准的阴道制剂仅有甲硝唑阴道片、孕酮阴道片、孕酮阴道胶囊剂及阴道栓剂。中国2000年后批准[6]的国产阴道制剂38种共123个批件,批准6个品种共9个批文进口。
由上述批准信息可知,国外批准上市的阴道途径给药品种较少,中国批准的相对较多。
2 阴道制剂药典收载情况
USP40[7]收载2种阴道栓(1种撤市) 、5种乳膏剂(2种撤市)与7种植入剂(2种撤市,3种未查到相关上市品种),且部分已退市或FDA网站上查询不到相关制剂;BP2017[8]收载3种阴道片、3种阴道栓;Ch.P2015[9]收载4种阴道片、4种阴道泡腾片、1种阴道胶囊与2种阴道栓;JP16[10]未收载阴道制剂。相比较,仅USP收载了植入剂,仅《中国药典》收载了阴道泡腾片与阴道软胶囊,阴道栓剂、阴道片较为常见。

3 FDA和EMA阴道制剂等效研究审评理念与审评案例
FDA、EMA均无针对阴道制剂治疗等效性的指导原则,且批准上市的阴道途径给药仿制药品种较少,仅能通过FDA和EMA对局部作用药物的评价观点/FDA公布的具体阴道制剂生物等效性指导原则,及公开的具体品种审评信息,来认识阴道制剂治疗等效性评价的理念。
3. 1 FDA 等效研究审评理念
仿制药可替代性[11]是指仿制药预期应与参比制剂达到药学等效、生物等效和治疗等效。对于生物等效,根据21CFR320.24,可以使用不同类型的证据来建立药学等效制剂的生物等效性,包括体内体外或体内外试验。用于证明生物等效性方法的选择取决于研究目的、可用的分析方法和制剂本身性质。根据这一规定,仿制药开发者必须使用21CFR320.24中规定的最准确、灵敏和可重现的方法进行生物等效性测定。FDA指出[12],对于2个口服固体制剂生物等效性的测定,一般会采用健康受试者单剂量或多剂量给药后比较生物体液(诸如血液或尿液)中的药物和/或代谢物浓度。而在无法采用上述方法的情况下,FDA会依据21CFR320采用其他体内或体外方法来评估生物等效性。仿制药办公室评估生物等效性的体内外方法优先顺序如下:①药效学研究;②临床研究;③体内动物研究;④体外研究。虽然后两种方法从法规政策角度方面是可接受的,但过去仿制药办公室生物等效性小组仅依赖于体内药效学或临床研究来评估那些在生物体液中不会产生可检测到的药物或代谢物浓度制剂的生物等效性。药效学研究可以在相对较少的受试者中建立可接受的生物等效性数据,临床研究一般需要大量受试者且通常缺乏灵敏性。
目前,FDA评价局部作用介绍了[13]两种药物体外生物等效性评价方法:即基于Q3特征和性能的评价方法(Q3characterizationand performance equivalence)和证据权重方法( weight-of-evidence approach)。已有首个鼻用仿制药基于证据权重方法批准,但尚未查到阴道制剂的仿制药基于上述两种体外方法获准上市。
3. 2 FDA 批准的阴道制剂审评案例
FDA公布了10种阴道制剂生物等效性指导原则[14-23],显示FDA对于阴道途径给药品种大多推荐以临床为终点的BE研究,即使部分品种明确了体外溶出度测定方法,但仍需要进行临床研究,以评价其安全性和有效性。
3. 3 EMA 等效研究审评理念
EMA[3]对于局部作用药物治疗等效性的评价,原则上需进行临床试验,但是也可以使用或开发其他模型。在这种情况下,可以考虑人体药效学研究、局部生物利用度研究,甚至动物或体外研究,前提是各个方法/模型被充分验证。另外,安全性和局部耐受性应进行合理说明。EMA也提到[24],对于局部使用且预期在局部发挥作用的溶液剂( 如滴眼剂、鼻喷雾剂或皮肤溶液剂)在一定条件下可豁免提供等效性数据。即要求受试制剂的溶液类型(水溶液或油性溶液)、主成分浓度、给药途径与参比制剂相同,且如果受试制剂与参比制剂的药学特性相同或基本相似,可接受辅料组成的微小差别,而对于辅料种类(Q1)或用量(Q2)的任何差别,均需证明对治疗等效性的影响。当局部作用药物存在全身不良反应的暴露风险时,应测定全身暴露量,且证明受试制剂的全身暴露不高于参比制剂。
EMA在《胃肠道局部作用药物治疗等效性指导原则》中提到[25],评价胃肠道局部作用药物治疗等效性研究的替代方法可按照从简单到复杂顺序,一般包括:单独药学评价数据、药学评价数据+体外模型、药学数据+体内PK数据以及药学数据+体外模型+体内PK数据。这些替代性方法的使用需要重点考虑产品质量(如:关键质量属性)以及给药途径。例如:在一些特定的情况下,可以豁免体内PK生物等效性,如:受试制剂和参比制剂均为溶液,产品具有相似的关键质量属性,且产品组成和各组分含量也相似,给药途径也相同。
3. 4 EMA 批准的阴道制剂审评案例
经检索欧盟临床试验登记平台( EU clinical trials register) [26],结果显示,对于仿制药,局部起效或是局部起效伴随全身暴露风险的阴道制剂,均应进行临床终点实验。具体示例如下。
① 仿制药,局部起效(2017-1-9):Nameof Sponsor: Verisfield (UK ) Ltd. , Greekbranch;Country:Greece。结论: 开展一项疗效等效( 非劣效) ,随机,单盲,平行,临床试验,用于评价克林霉素阴道栓( 100 mg) 仿制药相比辉瑞公司克林霉素阴道栓( 100 mg) ,治疗细菌性阴道炎的有效性和耐受性。
② 仿制药,局部起效且有全身暴露( 2017-4-13) : Nameof Sponsor: Helm AG;Country:Germany。结论: 开展一项疗效等效,双盲,双模拟,多次给药,平行,安慰剂和参比制剂对照,临床试验,用于评价雌二醇阴道片仿制药( 10 μg) 相比参比制剂( Vagifem),治疗围绝经期女性阴道萎缩症,并评估全身暴露风险。
4 阴道制剂药学审评要点
4. 1 FDA 对阴道制剂仿制药处方要求
汇总分析了部分FDA 批准的阴道制剂审评报告( 或仿制药批准包approval package) ,见表1。
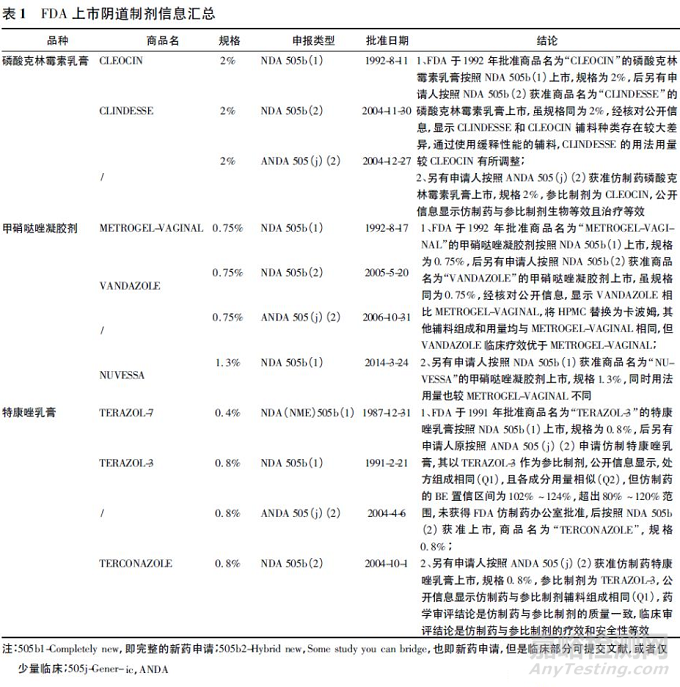
由表1 可知,对于阴道乳膏剂和凝胶剂,Q1 相同是在FDA 按仿制药申报的必要条件,但不是充分条件。Q1( 如基质) 不同可能影响产品特性,而需按新处方药申报;即使Q1 相同、Q2 相似,临床疗效也有可能有差异,而需按照新处方类型申报。
4. 2 关键质量属性
查阅FDA 批准上市的阴道制剂的审评报告[27-31],并对药学审评要点进行汇总,见表2。
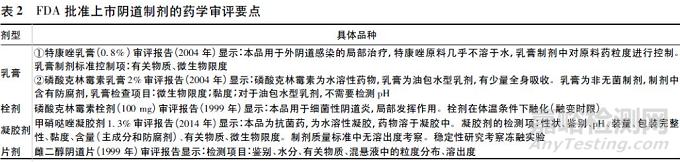
由表2 可知,除常见关键质量属性如有关物质、含量测定及微生物限度外,还有因制剂特点产生的不同关键质量属性,如乳膏剂与凝胶剂的黏度、栓剂、片剂及胶囊剂的融变时限;与临床疾病、作用部位特点相关的关键质量属性,如pH 值( 或酸性,油包水型除外) ;及与化合物特点相关的关键质量属性,如水溶性不好原料药的粒度或制成混悬液的粒度分布、晶型。
4. 3 处方工艺合理性
阴道制剂仿制药还需关注处方工艺的合理性,如生产工艺设计不合理,则不支持评价本品的质量可控性评价。如某阴道片中使用了辅料酒石酸和碳酸氢钠拟定采用湿法制粒,同品种仿制药均采用制粒后外加混合。因酒石酸和碳酸氢钠起崩解剂的原理就是遇水产生气体从而使片剂崩解,而按拟定生产工艺操作,酒石酸和碳酸氢钠在制粒过程中遇水会发生反应,从而影响在成品中的崩解作用,其生产工艺设计不合理,不能支持评价产品的质量可控性。
5 结论与讨论
阴道制剂是指阴道途径给药,通常发挥局部作用,剂型种类较多。2000 年以来中国批准上市的产品最多,剂型包括片剂、泡腾片、栓剂、软胶囊、凝胶剂、霜剂、乳膏剂软膏剂;美国、欧盟、日本上市产品要少很多剂型包括乳膏、栓剂、片剂、凝胶剂。国际主流药典收载阴道给药品种的主要剂型为阴道栓与阴道片,《中国药典》独家收载有阴道泡腾片与阴道软胶囊的品种。阴道制剂仿制药的药学研究首先要关注处方工艺应具有合理性。其次,要关注关键质量属性研究的合理性、批间一致性及与原研产品的一致性,关键质量属性的确定通常需结合制剂特点、原料药特点临床给药特点。此外,FDA审评案例提示,对于阴道乳膏剂和凝胶剂,Q1相同是按仿制药申报的必要条件,但不是充分条件,即Q1相同、Q2相似的产品,临床疗效也有可能有差异,而按照新处方类型申报。FDA要求阴道制剂与原研产品在药学一致的基础上,方可申报仿制药,且通常需要通过临床研究进行与原研药品的疗效和安全性等效评价;对于与原研药品达到药学一致但临床研究不等效的产品,按新处方工艺申报;对于与原研药品药学不一致的产品,按新处方工艺申报。
目前,FDA和EMA均无针对阴道制剂治疗等效性的指导原则,EMA明确接受局部发挥作用的产品在溶液情况下豁免提供等效性数据,而对其他局部阴道制剂品种与FDA对所有局部作用阴道制剂一样,通常以临床试验研究来评价仿制药疗效和安全的一致性。而以临床为终点的生物等效性(BE)研究一般需要大量受试者,且通常缺乏灵敏,因此FDA和EMA支持采用可替代方法评价仿制药疗效的一致性,但由于当前可获得的模型较少,大多数还未被充分验证,且血浆浓度水平与局部疗效不相关,尚无获准上市案例。








