您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-05 09:05
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
诺华银屑病关节炎Ⅲb期头对头试验失败。诺华银屑病关节炎Ⅲb期头对头Exceed研究失败。该研究旨在评估Cosentyx与艾伯维的Humira治疗先前未接受过生物疗法治疗的活动性银屑病关节炎患者的疗效,52周的结果显示,尽管Cosentyx组有更多的患者达到了ACR20数值,但结果并不具备统计学意义。不过,试验中观察到Cosentyx在活动性银屑病关节炎特异性终点方面具有明显的统计学优势。此次试验中没有发现新的安全信号。Cosentyx是首个获批上市的IL-17A抑制剂,已获批用于治疗斑块状银屑病、银屑病关节炎和强直性脊柱炎,目前正在进行治疗其他炎症性疾病的临床试验。
国内药讯
1.绿叶抗肿瘤生物药LY01008临床新进展。绿叶制药在研抗体药物LY01008(Avastin®生物类似药)已于今年5月在中国完成一项与Avastin®疗效和安全性对比的III期临床试验的入组,共计入组648例患者。目前,该研究在盲态下已完成主要疗效指标客观缓解率的观察。LY01008为重组抗VEGF人源化单克隆抗体注射液,用于治疗非小细胞肺癌和结肠直肠癌,是罗氏重磅抗癌药Avastin®的生物类似药。据悉,Avastin®2018年的全球销售额达到68.49亿瑞士法郎,中国的销售额达到17.4亿元人民币。
2.君实抗肿瘤BTLA单抗临床试验首例患者给药。君实生物自主研发的抗肿瘤BTLA单抗(TAB004,JS004)美国I期临床研究NCT04137900首例患者给药。该研究旨在评估抗BTLA单抗注射液用于治疗晚期不可切除或转移性实体瘤患者(包含淋巴瘤)以及PD-1抗体耐药患者的安全性、耐受性和药代动力学,计划入组144例受试者。JS004是全球首个获批临床的抗肿瘤BTLA单抗,也是君实生物继抗PD-1单抗特瑞普利单抗后,第二个获FDA药物临床试验批准(IND)的自主研发、具有完全自知识产权的在研产品。
3.石药集团EpCAM/CD3双抗在美获批临床。石药附属公司友芝友生物研发的1类新药注射用重组抗EpCAM和CD3人鼠嵌合双特异性抗体(M701)获FDA临床批件。据悉M701为中国首个引入免疫和靶向多重机制的癌性腹水治疗药物,可通过CD3招募患者自身免疫T细胞,继而通过EpCAM引导免疫细胞靶向肿瘤细胞,最后启动T细胞杀伤肿瘤细胞,从而达到治疗腹水的效果。M701此前已获得中国和美国的发明专利授权,正在中国开展的临床试验已初步获得积极的结果。
4.辉瑞2款突破性药物在华获批临床。辉瑞的PF-06651600片和注射用头孢他啶阿维巴坦钠两款新药获国家药监局临床试验默示许可。PF-06651600片是一款JAK3抑制剂,开发用于治疗≥12岁患者中重度斑秃(包括全秃[AT]和普秃[AU]),该药此前已获FDA的突破性疗法认定。据悉,该药物还将继续开发用于治疗类风湿性关节炎(RA),克罗恩病(CD)和溃疡性结肠炎(UC)。注射用头孢他啶阿维巴坦钠(思福妥)是一款新型抗生素,开发适应症为医院获得性肺炎和呼吸机相关性肺炎(HAP/VAP)。该药今年5月已在华获批上市。
5.腾盛博药新型乙肝RNAi疗法临床申请获受理。腾盛博药递交的VIR-2218注射液(ALN-HBV02)临床试验申请获国家药监局受理。这是一款来自Vir公司的新型研究性RNA干扰治疗药物,能够抑制所有乙肝病毒(HBV)蛋白的表达,包括乙型肝炎表面抗原(HBsAg)。腾盛博药于2018年底引进该疗法,并将负责其在中国的临床开发。目前,评估VIR-2118在健康志愿者和慢性HBV感染者中的疗效与安全性的全球多中心的Ⅰ/Ⅱ期研究(NCT03672188)正在进行当中。
6.康方生物完成D轮融资。康方生物完成近1.5亿美元D轮私募融资。本轮投资由正心谷创新资本和中国生物制药领投,将用于推动其创新药的研究和临床开发。康方生物成立于2012年,致力于自主研发新一代创新型抗体药物。其独特的Tetrabody双功能抗体开发技术,开发了一系列以PD-1为基石的双功能抗体新药。其中AK104和AK112都是国际上首个进入临床研究的抗PD-1/CTLA-4及抗PD-1/VEGF双功能抗体新药,有望成为优于PD-1抗体药的新一代肿瘤免疫治疗手段。目前该公司30个抗体新药产品管线中10个品种处于国内及国际临床阶段。
国际药讯
1.11月面临FDA重要监管决定的药物。RTTNews网站分析本月将有多款药物迎来FDA最终审查决定。11月9日,FDA将对Lipocine公司的拟用于治疗男性性腺功能减退的睾酮替代疗法(TRT)Tlando作出审查决定;11月14日将对Amarin的鱼油衍生药物Vascepa降低心血管风险的补充新药申请进行讨论和表决。11月30日,FDA将对Aquestive公司拟用于肌萎缩侧索硬化症(ALS)的辅助治疗药物Exservan作出审查决定。另外还有艾尔建针对成人偏头痛急性治疗的口服药物ubrogepant以及辉瑞/安斯泰来的前列腺癌药物Xtandi治疗男性转移性激素敏感前列腺癌(mHSPC)的补充新药申请正在接受FDA的审查,预计本季度也做出审查决定。
2.安斯泰来PPARδ调节剂ASP1128获快速通道资格。安斯泰来选择性PPARδ调节剂ASP1128获FDA授予快速通道资格,用于治疗冠状动脉搭桥和/或瓣膜(CABG/V)手术后发生中重度急性肾损伤(AKI)风险增加的患者。临床前数据显示,在急性缺血再灌注损伤后,用ASP1128进行干预可改善线粒体功能、整体能量代谢和肾脏性能。在AKI动物模型中,ASP1128改善了肾功能、组织病理学和损伤生物标志物。目前,ASP1128的概念验证II期研究1128-CL-0201正在进行中。
3.诺华脊髓性肌萎缩症新药Zolgensma部分临床试验被叫停。诺华宣布,FDA部分暂停了其用于脊髓性肌萎缩症(SMA)的基因治疗药物Zolgensma(AVXS-101)鞘内给药的临床试验,诺华旗下AveXis公司与卫生监管部门和临床试验研究者沟通了一项小型临床前研究的结果,该研究中动物实验结果显示背根神经节 (DRG) 单核细胞炎症,有时伴有神经元细胞体变性或丢失,这可能会影响感知功能。Zolgensma今年5月已获FDA批准用于治疗两个编码运动神经元生存蛋白(SMN)的SMN1等位基因上携带突变的2岁以下的SMA患者。诺华表示该试验暂停不影响已上市的Zolgensma或是其静脉给药(IV)的临床试验。
4.Maze完成新一轮融资。生物技术公司Maze Therapeutics宣布完成由City Hill Ventures领导的投资,本次融资具体金额未公布。据悉,Maze拟利用本轮融资资金打造基因修饰平台,并针对遗传性疾病开发靶向药物。Maze成立于2018年,是一家早期生物技术公司。该公司致力于开发治疗多种遗传性疾病的新型靶向药物。Maze的基因修饰平台结合了功能基因组学和遗传学的先进知识,可对大规模人类遗传数据进行分析,并将可利用的生物分子转化为新药。
5.Tmunity Therapeutics完成B轮融资。专注于T细胞免疫疗法的Tmunity公司宣布完成B轮7500万美元的融资。本轮融资由Andreessen Horowitz领投。Tmunity成立于2015年,目前已有3款候选药物进入临床阶段,包括一款经过双重改造拟用于治疗前列腺癌的PSMA CAR-T疗法和拟用于治疗骨髓瘤、黑色素瘤和滑膜肉瘤的NY-ESO-1 TCR-T Triple Knockout TCR(NYCE)。本轮资金将用于支持正在进行中的以及计划中的研究,在研产品的临床开发以及建立公司专有的、垂直整合的病毒载体和细胞疗法产品的生产平台,并计划在2021将产品推进至Ⅱ期临床。
医药热点
1.基本药物保障水平大幅提升。中国药学会发布《2019年中国药学会医院用药监测报告》。《报告》指出,5年多来,医院不同类别药品的品种数、金额、用量占比增速趋缓,反映了医院用药结构处于总体稳定状态,但抗肿瘤和免疫调节剂的使用金额占比持续上升。在基本药物方面,2019年上半年数据显示,样本医院基本药物使用品规数由783个增长至1052个,金额占比由12.1%增长至27.2%,使用频度占比由31.3%增长至47.1%,日均费用由5元增长至7.5元。其中,抗肿瘤和免疫调节剂品规增幅达81.4%,相关人群成为2018年基本药物政策调整的最大受益者。
2.日本学生近视率高达9成。据日媒报道,近日,日本庆应大学针对东京都内的小学生和初中生,实施了一项近视情况调查。此次的调查对象一共有1416人,其中小学生689名、初中生727名。结果显示,被调查对象中,小学生的近视率为76.5%,而初中生则高达94.9%。其中,至少有72名初中生患有高度近视,占比达到了9.9%。分析称,高度近视极有可能引发视网膜脱落或绿内障等导致失明的眼疾。
3.华西医院:开展腹腔镜结肠癌根治术日间化治疗。近日,华西医院胃肠外科王自强教授团队联合日间病房、日间手术室及华西第四医院在国内率先开展腹腔镜结肠癌根治术日间化治疗,患者围手术期康复顺利。据悉,经过前期调研,王自强教授团队发现腹腔镜结肠癌术后围手术期严重并发症发生率极低,可以考虑开展日间化治疗。该模式具有康复快、花费少等优点,既往对于腹腔镜结肠癌根治术等大型手术国内尚未开展日间手术。目前,该模式下病人日间手术术后转入华西第四医院,后期将推广患者家庭康复及社区医院康复治疗。
4.上海实行护士多机构备案。为了进一步引导护士人力资源合理流动,提高优质护理资源可及性,《上海市护士区域注册管理办法》于近日制定实施。目前,上海市注册的护士执业地点为上海市行政区划,护士同时在上海市多个医疗机构执业的,应确定一个作为主要执业机构,其他的向拟备案的医疗机构发证机关申请备案。由此,执业机构由“1”扩至“1+N”。护士多机构备案实行网上办理,护士可通过电子化注册系统个人端或登录“中国上海”在线申请。
股市资讯
.
【恒瑞医药】公司及子公司上海恒瑞医药有限公司获得临床试验通知书。经审查,2019年7月24日受理的SHR6390片符合药品注册的有关要求,同意批准本品开展一项SHR6390联合来曲唑或阿那曲唑对比安慰剂联合来曲唑或阿那曲唑治疗HR阳性、HER2阴性晚期乳腺癌的双盲、多中心、随机III期临床研究。
【康龙化成】公司本次发行上市的保荐人已于11月1日收到香港联交所向其发出的信函,其中指出香港联交所上市委员会已审阅公司的上市申请,但该信函不构成正式的上市批准,香港联交所仍有对公司的上市申请提出进一步意见的权力。
【健民集团】截至2019年11月4日,间接控股股东华立集团新增公司股份57.41万股,增持均价16.82元/股,合计使用资金965.40万元。
审评动向
1. CDE最新受理情况(11月04日)
暂无
2. FDA最新获批情况(北美11月03日)
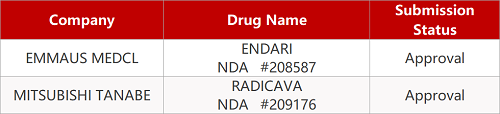

来源:药研发


