您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-10-31 10:20
摘要:
目的:考察自愈型水凝胶的生产及应用现状,并探讨其在医疗器械领域的应用前景,为开展下一步的研究工作提供参考。
方法:通过查阅近年的文献资料,总结自愈型水凝胶包含的不同结构单元的性质,阐述其实现自愈的原理,以及应用于组织工程产品的研究进展,并对其在生物医药领域的应用进行展望。
结果与结论:自愈型水凝胶具有良好的自修复性、可降解性及生物相容性,但力学性能不足等问题限制了其在临床中使用。在未来的研究中,通过对结构改性解决现存问题,自愈型水凝胶会在医疗器械领域中具有很好的应用前景。
关键词:自愈型水凝胶 组织工程 医疗器械
水凝胶是一种由共价键和非共价键交联而形成三维网络结构的黏弹性半固体材料,具有成分和结构的多样性、环境响应性、高含水量及生物组织相似等特性[1-3],成为替代天然生物软组织材料的优先选项,在组织工程、缓释药物载体、生物传感器等生物医学领域有着广泛的应用价值及前景[4]。
1 背景介绍
由于水凝胶是一种软性材料,机械形变会使水凝胶产生宏观或者微观的裂纹,影响其力学性能。如果水凝胶具有自愈合性能,能够自行修复损伤,则可大幅延长使用寿命,同时增加产品适用性。
早期开发的自愈型材料中含有微胶囊、纳米管等结构,在其中含有交联剂、催化剂或单体,在断裂处可以发生聚合,达到修复的目的(如图 1)[5]。然而,这种不可逆的结构只能修复一次,是一个潜在的缺点,因此,人们对可逆的自愈系统开展了更多的研究[6]。
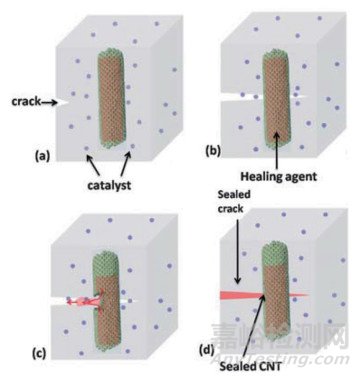
(a)外力使材料受损;(b)自愈剂释放;(c)在裂缝处发生原位聚合反应;(d)恢复裂缝及机械性能。
图 1 基于碳纳米管结构的自愈模型
水凝胶实现自愈需要两个过程,即流动和修复。首先,水凝胶的三维亲水性结构中,多含有羟基、羧基、酰胺基、磺酸基等亲水基团,可以键合大量的水,在受到外部影响时,能够在损伤区域产生流动相以填充裂纹[7];其次,在外界或者无外界刺激下,自愈型水凝胶通过共价键(如酰腙键、亚胺键、双硫键、Diels-Alder可逆共价键等)或非共价键(如氢键、疏水作用力、结晶等)可逆反应交联而成,在受损后,可通过可逆反应重新交联,完成自我修复[8-10]。
一类自愈型水凝胶是在外界刺激下,如光照、加热、酸碱条件、氧化还原反应等作用下实现自我修复[11-13]。然而,当水凝胶植入人体内使用时,很难具备上述条件,外界环境无法刺激到水凝胶。因此,在生物医药领域,无需外界刺激即可自愈的水凝胶是新的研究方向。
2 自愈型水凝胶结构分类
动态共价化学和超分子化学的概念由Lehn[14-15]提出,很多化学键在一定条件下可逆平衡。随后,很多研究将这两个理论应用于自愈型水凝胶制备中,大大促进了自愈型水凝胶的发展。根据这两个理论形成了两个研究方向:一类是基于超分子化学中弱相互作用力的自愈型水凝胶,另一类是基于动态共价化学的自愈型水凝胶。
2.1 利用超分子作用实现自愈的水凝胶
超分子化学主要依靠氢键相互作用、π-π相互作用、离子相互作用、主客体包含作用、金属配位键等分子间作用力形成分子网络体系,这些非共价键相互作用一般较弱且具有一定的可逆性,可使分子或分子链在损伤处相互融合形成新的交联网络。
2.1.1 氢键作用
氢键间作用力是一种弱分子间作用力,氢键的打开和连接相对容易,在多重氢键的存在情况下,氢键之间的协同做用可以具有较强的结合能。因此,在凝胶被破坏后,可以实现重新连接,以达到自愈的目的[16-18]。纤维素中存在较多的氢键,使用纤维素和聚乙烯醇、硼砂混合,可以制备具有一定机械性能和自愈性能的水凝胶[16]。LIN等[19]通过甲基丙烯酸酯封端聚氨酯醚预聚物与含有2-脲基-4-嘧啶基的2-(3-(6-甲基-4-氧-1,4-二羟基嘧啶)-脲基)乙基丙烯酸甲脂(SCMHBMA)共聚,获得了具有四重氢键的聚氨酯(PU)水凝胶,该水凝胶具有很好的自愈合性能。HONG等[20]利用聚乙烯醇(PVA),通过物理交联获得了一种稳定性较高的水凝胶,利用PVA中较多的羟基形成多重氢键,达到自愈合的目的。
2.1.2 π-π键相互作用
该作用是利用芳香环中的π-π键相互作用达到自愈合目的。Burattini等[21-22]利用聚酰亚胺和含芘基团的聚氨酯制备可以自愈合的共聚物,这种材料存在缺π电子的酰亚胺基团和富π电子的芘基团,两者可以形成π-π键相互作用进而实现自愈。
2.1.3 疏水作用
Kauzmann[23]在1959年提出了疏水作用力这一概念,指出为了减少暴露在水中的非极性表面积,任何两个在水中的非极性表面积将倾向于结合在一起。利用这一特性,Tuncaboylu等[24]利用十二烷基硫酸钠胶束与丙烯酰胺发生共聚,合成了亲疏水相互嵌段的高分子,制备了具有良好拉伸性能的自愈型水凝胶。该课题组后续利用亲水性单体N, N-二甲基丙烯酰胺(DMA)与疏水性单体甲基丙烯酸十八酯(C18)为原料,在十二烷基硫酸钠(SDS)和氯化钠的混合溶液中,同样制备了具有高弹性能的自愈型水凝胶[25-26]。
2.1.4 金属配位相互作用
金属配位键的动力学不稳定,含有金属离子的水凝胶,可以通过配位键结合实现自愈合目的。Asoh等[27]通过三联吡啶封端的三臂聚乙二醇和钴离子为原料,合成了一种自愈型水凝胶,可以在室温环境中,20分钟完成自愈合。Yan等[28]利用冠醚分子和金属交联剂制备交联超分子聚合物凝胶,这种金属离子配位交联聚合物的水凝胶具有良好的自愈性。Liang等[29]以锌离子和单磷酸腺苷为原料,通过配位键络合得到了一种超分子水凝胶,该水凝胶在离心分离的情况下,可以自行汇聚成一体,表现出了自愈性。
2.2 利用共价键作用实现自愈的水凝胶
具有动态共价化学键的自愈型水凝胶,既具有共价键的稳定性质,又具有一定的可逆性,在凝胶分子内部引入这类共价键(如酰腙键、亚胺键、二硫键、Diels-Alder可逆共价键等),可以在这类共价键被破坏后,通过可逆反应实现凝胶自愈合功能。
2.2.1 二硫键作用
二硫键在材料中能发生交换反应,硫醇基或二硫化物可以通过自由基交换完成重建。由于蛋白质中含有大量二硫键,所以研究二硫键自愈合性能在生物材料中有很大前景。Yang等[30]将含有二硫键的二(2-甲基丙烯酸硫乙酯)[Bis(2-methacryloyl)oxyethyl disulfide,BMOD]作为交联剂,制备了一种具有自愈合性能的抗菌水凝胶,可以自愈的同时保持抗菌性能,具有很好的前景。
2.2.2 亚胺键(席夫碱)作用
亚胺键(席夫碱)是指含有亚胺或者甲亚胺特征基团的化合物,通常由胺和活性羰基缩合而成[31]。Xu等[32]通过天然香草醛用作交联剂,与壳聚糖进行反应,可以得到具有自愈性的水凝胶。香草醛的醛基通过席夫碱反应与壳聚糖分子中的氨基反应,其羟基与另一壳聚糖分子的羟基或氨基形成氢键,构成了可逆结构。同样,利用席夫碱反应,Liu等[33]将氧化海藻酸钠(oxidized sodium alginate, OSA)及丙烯酰胺单体(acrylamide,AM)聚合,形成OSA-PAM水凝胶,该水凝胶同样具有亚胺键及氢键,两者协同作用使水凝胶具有很好的力学性能和自愈合性能。
2.2.3 酰腙键作用
酰腙键是由含酰肼基团与含醛、酮基团的聚合物缩合而形成的共价键,该缩合反应在酸性条件下是可逆的。利用这一性质,Qiao等[34]利用二醛封端的聚乙二醇(Dialdehyde-terminated PEG,PEG–CHO)和己二酸二酰肼改性的藻酸盐(adipic dihydrazide-modified alginate, ALG-ADH)交联聚合,制备具有自愈性能的水凝胶,该研究中在水凝胶内加入四环素盐酸盐,研究其在pH=4的环境中的释放情况,结果良好,证明该水凝胶具有药物递送能力。An等[35]利用二酰肼化合物共聚交联,制备一种具有很好的生物相容性的自愈型水凝胶P(NIPAM-FPA-DMA),水凝胶中的PNIPAM骨架具有可逆热响应,DMA共聚可以调节水凝胶相变温度至体温,实现了很好的自愈性和生物相容性。
2.2.4 狄尔斯-阿尔德反应
狄尔斯-阿尔德(Diels-Alder,DA)反应是由共轭双烯与亲双烯体构建环己烯骨架的经典反应[36]。Yu等[37]利用DA反应和酰腙键作用,设计了一种具有很好生物相容性的自愈型水凝胶。Smith等[38]通过DA反应,利用透明质酸钠-呋喃与2-马来酰亚胺聚乙二醇合成的水凝胶,在生理pH环境下,可以包封活细胞,是一种很好的组织工程材料。
3 自愈型水凝胶在组织工程产品中的应用
自愈型水凝胶作为一种新型材料,在医疗领域有很广泛的应用前景。相对于普通水凝胶,其力学性能更为优异;同时,在发生断裂破损等情况时,可以自愈,延长使用寿命。所以,自愈型水凝胶作为组织工程产品的原料,需要具备3个关键的性能:
1)具有良好的生物相容性;
2)在生理条件下可以自主性愈合,无需外界刺激,自愈过程不受体内其他成分的影响;
3)可实现多次重复性自愈合,可在失去力学性能前完成自愈。
要满足上述3个条件并不容易,现阶段主要研究的应用方向有以下几点:
3.1 可注射水凝胶
早期的可注射水凝胶多包覆药物,直接注射至病灶处,由水凝胶中的药物缓释起到治疗效果,由于局部药物浓度高,相对于口服或静脉输注等手段,具有见效快、用药量少等优势[39-41]。但由于其在注射过程中保持结构稳定性的能力较差,药物存在突释的可能,结构变化也会使凝胶变性堵塞针管。因此,新型自愈型水凝胶的优势得以发挥,以亚胺键聚合的水凝胶可以通过26号针头(ϕ=260μm)而不会发生堵塞[42];同时,该水凝胶的动物实验结果表明,其具有很好的生物相容性。通过测量该水凝胶结构改变时的储能模量G'和损耗模量G''改变,证明其具有较好的机械性能自修复能力。该凝胶在保证治疗效果的同时,解决了结构稳定性差的问题。自愈型水凝胶具有更好的机械性能和修复性能,相对于传统水凝胶,在药物递送等领域,具有更好的前景[43-47]。
3.2 组织工程支架
对于器官受到创伤造成缺失的患者,相对于器官移植来源有限及排异反应的风险,组织工程医疗器械是一种很好的治疗手段。作为组织工程修复材料,自愈型水凝胶不仅应该与受损组织周围的微环境在物理和化学上相似,而且还应该是无毒的、可降解的、药物/生长因子/蛋白质释放可控的。相对于传统组织工程支架材料,自愈型水凝胶在软骨组织、神经系统及颅骨修复手术中,作为一种支架材料具有很好的治疗效果[48-49]。
当水凝胶处于患处时,可以提供一定程度的机械性能,保证组织可以生长。与传统支架材料相比,可注射自愈型水凝胶由于具有可逆的溶胶-凝胶转变特性,可以更好地修复不规则损伤。葡聚糖-脲基-嘧啶酮(DEX-UPy)强力水凝胶被证明适合作为支架材料的软骨修复[48]。将具有骨形态发生蛋白2(BMP-2)的软骨细胞和骨髓干细胞(BMSC)包封在水凝胶中。软骨细胞可促进软骨再生,BMSCs / BMP-2可促进骨再生。将含有软骨细胞和BMSC / BMP-2的凝胶装入注射器中,然后注射。由于固有的剪切稀化性能,液体形式的凝胶在注射后迅速重新凝胶化,最后整合,模拟了骨骼上软骨生长的生理状态。动物实验[49]表明,自愈型水凝胶独特的自我修复和注射性能可以修复机械磨损并延长使用寿命,用以支持长期组织生长。
3.3 抗菌敷料
作为与皮肤接触的材料,敷料需要具有抗菌性能、促进再生的性能及抵抗日常运动引起的磨损性能[50]。同时,由于伤口一般是不规则的,水凝胶的可塑性具有很大的优势[51]。
自愈型水凝胶的另一个优势是具有较长使用寿命,可以防止因为敷料失效引起伤口炎症反应。Zhao等[52]开发了一系列基于季铵化壳聚糖-g-聚苯胺(quaternized chitosan-g-polyaniline,QCSP)和苯甲醛基-聚(乙二醇)-聚(甘油癸二酸酯)(benzaldehyde group functionalized poly(ethylene glycol)-co-poly(glycerol sebacate,PEGS-FA)的自愈型水凝胶,该水凝胶具有良好的抗菌性、粘合性、生物相容性和自愈性能,同时可以促进伤口愈合,具有很好的研究前景。
3.4 药物递送载体
抗肿瘤药具有较强的细胞毒性,常规的口服化疗药物对人体正常细胞伤害较大。将抗肿瘤药物包覆于自愈型水凝胶中,直接注射到肿瘤附近,降低了对其他器官伤害的同时,也提高了对肿瘤靶向治疗的效果[53-54]。含药水凝胶在注射到病变处后,可以保持较为稳定的三维网状结构,可控地释放药物,达到治疗效果[55-56]。同时,含有壳聚糖基团的水凝胶对pH较为敏感,有研究[53]表明,载有氟尿嘧啶(5-Fu)抗肿瘤药物的壳聚糖-聚乙烯醇(CS-PVA)水凝胶,在pH=5.0的酸性环境(模拟肿瘤细胞的酸性环境),相对于中性环境,可以更持久和稳定地释放药物,具有更好的抗肿瘤效果,但是现有设计出的水凝胶的稳定释放能力还存在问题,很难达到临床使用要求。
4 问题与挑战
非自主自愈型水凝胶的自我修复过程必须受到一些外部刺激(如光、热、pH或催化剂),这不仅使愈合过程复杂化,而且限制了其在体内的应用。例如,需要在高于或低于生理pH值的刺激的一些自我修复过程,这不可避免地对细胞或组织造成损害。此外,结构单元的自愈合要求也影响了水凝胶的使用环境。例如,酰腙键只能在温和的酸性条件下保持稳定,通过可逆酰腙键交联的可注射自愈型水凝胶不能应用于胃粘膜修复支架,因为胃中过量的酸将导致酰腙键的破裂并因此导致凝胶-溶胶转变,致使支架失效。
迄今为止,大多数自愈合凝胶仍处于理论研究阶段并且缺乏实际应用,主要是因为它们的机械性能差并且不能与天然组织的机械性能相匹配。受制于对生物相容性和自愈性能的要求,现有的大多数水凝胶承受应力在Pa与kPa之间。因此,在现有机理研究的基础上,应更多地关注水凝胶力学性能的改进。
了解自愈机制对自愈型水凝胶的设计和应用具有重要意义,现阶段对原子尺度和分子尺度的研究非常有限,大多数研究仅基于结构的定性研究和评估。解决机械性能不足,以及自愈过程稳定性等问题,需要从分子结构-宏观尺度进行理论和实验研究,定量分析聚合材料结构单元,是未来对这类材料研究的重点。
5 总结和展望
组织工程材料在受到机械或化学损伤后,如果可以通过自身的自愈性能完成修复,将延长使用寿命,提高安全性,具有更大的使用前景,因此,对水凝胶自愈机制的研究至关重要。同时,多种功能基团的引入,也为自愈型水凝胶的发展提供了新的方向,例如加入光敏基团可以携带光敏药物,包埋神经干细胞用于修复神经及肌肉等[57-59]。
现阶段已经研究出多种结构单元的自愈型水凝胶,这些结构单元具有不同的自愈合机理,在不同的环境下实现自愈合的目的。但是,自愈型水凝胶还存在各种问题,需要在结构分析中进一步地研究,在解决这些问题后,相信自愈型水凝胶具有很广阔的发展前景。
参考文献
[1] Gupta A, Low W L, Radecka I, et al. Characterisation and In Vitro Antimicrobial Activity of Biosynthetic Silver-Loaded Bacterial Cellulose Hydrogels[J]. J. Microencapsul, 2016(33): 725-734. DOI:10.1080/02652048.2016.1253796
[2] Capanema, Nádia S V, Mansur A A P, et al. Superabsorbent Crosslinked Carboxymethyl Cellulose-PEG Hydrogels for Potential Wound Dressing Applications[J]. International Journal of Biological Macromolecules, 2018(106): 1218-1234.
[3] Fan L, Yang H, Yang J, et al. Preparation and Characterization of Chitosan/gelatin/PVA Hydrogel for Wound Dressings[J]. Carbohydrate Polymers, 2016(146): 427-434.
[4] Hoffman A S. Hydrogels for Biomedical Applications[J]. Annals of the New York Academy of Sciences, 2012(64): 18-23.
[5] Lanzara G, Yoon Y, Liu H, et al. Carbon Nanotube Reservoirs for Self-healing Materials[J]. Nanotechnology, 2009, 20(33): 335704. DOI:10.1088/0957-4484/20/33/335704
[6] Bergman S D, Wudl F. Mendable Polymers[J]. Journal of Materials Chemistry, 2007, 18(1): 41-62.
[7] Wei Z, Yang J H, Zhou J, et al. Self-Healing Gels Based on Constitutional Dynamic Chemistry and Their Potential Applications[J]. Chemical Society Reviews, 2014, 43(23): 8114-8131. DOI:10.1039/C4CS00219A
[8] 董坤, 魏钊, 杨志懋, 等. 自愈合凝胶:结构、性能及展望[J]. 中国科学:化学, 2012(42): 741-756.
[9] Chen Y M, Dong K, Liu Z Q, et al. Double Network Hydrogel with High Mechanical Strength:Performance, Progress and Future Perspective[J]. SciChina Technol Sci, 2012(55): 2241-2254. DOI:10.1007/s11431-012-4857-y
[10] Kakuta T, Takashima Y, Nakahata M, et al. Preorganized Hydrogel:Self-healing Properties of Supramolecular Hydrogels Formed by Polymerization of Host-Guest-Monomers that Contain Cyclodextrins and Hydrophobic Guest Groups[J]. Adv Mater, 2013(25): 2849-2853. DOI:10.1002/adma.201205321
[11] Yoshida R. Self-Oscillating Gels Driven by the Belousov-Zhabotinsky Reaction as Novel Smart Materials[J]. Adv Mater, 2010, 22(31): 3463-83. DOI:10.1002/adma.200904075
[12] Murata K, Aoki M, Suzuki T, et al. Thermal and Light Control of the Sol-Gel Phase Transition in Cholesterol-Based Organic Gels. Novel Helical Aggregation Modes As Detected by Circular Dichroism and Electron Microscopic Observation[J]. J. Am. Chem. Soc., 1994, 116(15): 6664-6676. DOI:10.1021/ja00094a023
[13] Lee C T, Smith K A, Hatton T A. Photoreversible Viscosity Changes and Gelation in Mixtures of Hydrophobically Modified Polyelectrolytes and Photosensitive Surfactants[J]. Macromolecules, 2004, 37(14): 5397. DOI:10.1021/ma036019e
[14] Lehn J M. Supramolecular Polymer Chemistry-Scope and Perspectives[J]. Polym Chem, 2010, 1(7): 978-987. DOI:10.1039/c0py00104j
[15] Lehn J M. From Supramolecular Chemistry Towards Constitutional Dynamic Chemistry and Adaptive Chemistry[J]. Chem. Soc. Rev, 2007, 36: 151-160. DOI:10.1039/B616752G
[16] 唐黎明. 多重氢键超分子聚合物[J]. 高分子通报, 2011, 144(4): 126-135.
[17] 王宇, 唐黎明. 氢键识别超分子聚合物的新进展[J]. 化学进展, 2007, 85(5): 769-778. DOI:10.3321/j.issn:1005-281X.2007.05.017
[18] 王毓江, 唐黎明. 基于氢键作用结合的超分子聚合物[J]. 化学进展, 2006(Z1): 308-316.
[19] Spoljaric S, Salminen A, Luong N D, et al. Stable, Self-Healing Hydrogels from Nanofibrillated Cellulose, Poly (VinylAlcohol) and Boraxvia Reversible Crosslinking[J]. J Eur Polym J, 2014(56): 105. DOI:10.1016/j.eurpolymj.2014.03.009
[20] Haoqun H, Haiyang L, Shujia C, et al. Facile Method to Prepare Self-Healable PVA Hydrogels with High Water Stability[J]. Materials Letters, 2014(122): 227-229.
[21] Burattini S, Greenland B W, Merino D H, et al. A Healable Supramolecular Polymer Blend Based on Aromatic Pi-Pi Stacking and Hydrogen-Bonding Interactions[J]. Journal of the American Chemical Society, 2010, 132(34): 12051-12058. DOI:10.1021/ja104446r
[22] Burattini S, Colquhoun H M, Greenland B W, et al. A Novel Selfhealing Supramolecular Polymer System[J]. Faraday Discussions, 2009, 143(3): 251-264. DOI:10.1039/b900859d
[23] Kauzmann W. Some Factors in the Interpretation of Protein Denaturation[J]. Adv Protein Chem, 1959(14): 1-63. DOI:10.1016/S0065-3233(08)60608-7
[24] Tuncaboylu D C, Sari M, Oppermann W, et al. Tough and Self-Healing Hydrogels Formed via Hydrophobic Interactions[J]. Macromolecules, 2011(44): 4997.
[25] Algi M P, Okay O. Highly Stretchable Self-Healing Poly (N, N-Dimethylacrylamide) Hydrogels[J]. Eur Polym J, 2014(59): 113-121.
[26] Gulyuz U, Okay O. Self-Healing Poly (N-isopropylacrylamide) Hydrogels[J]. Eur Polym J, 2015(72): 12-22.
[27] Asoh T, Kikuchi A. Rapid Fabrication of Reconstructible Hydrogels by Electrophoretic Microbead Adhesion[J]. Chem. Commun, 2012(48): 10019-10021.
[28] Yan X, Xu D, Chen J, et al. A Self-Healing Supramolecular Polymer Gel with Stimuli-Responsivenese Constructed by Crown Ether Based Molecular Recognition[J]. Polymer Chemistry, 2013, 4(11): 3312-3322. DOI:10.1039/c3py00283g
[29] Liang H, Zhang Z, Yuan Q. Self-Healing Metal-Coordinated Hydrogels Using Nucleotide Ligands[J]. J. Chem Commun, 2015, 51: 15196s-15199. DOI:10.1039/C5CC06824J
[30] Yang W J, Tao X, Zhao T, et al. Antifouling and Antibacterial Hydrogel Coatings with Self-Healing Properties Based on a Dynamic Disulfide Exchange Reaction[J]. Polym Chem, 2015(6): 7027-7035.
[31] 南光明, 刘德蓉. 浅述席夫碱及其金属配合物的由来、产生机理、合成方法及展望[J]. 伊犁师范学院学报, 2005(3): 58-59. DOI:10.3969/j.issn.1009-1076.2005.03.018
[32] Xu C H, Zhang W, Tang X Z, et al. Self-Healing Chitosan/Vanillin Hydrogels Based on Schiff-Base Bond/Hydrogen Bond Hybrid Linkages[J]. Polymer Testing, 2018(66): 155-163.
[33] Liu S L, Kang M M, Li K W, et al. Polysaccharide-Templated Preparation of Mechanically-Tough, Conductive and Self-Healing Hydrogels[J]. Chemical Engineering Journal, 2018(334): 2222-2230.
[34] Qiao L, Liu C, Liu C, et al. Self-Healing Alginate Hydrogel Based on Dynamic Acylhydrazone and Multiple Hydrogen Bonds[J]. J Mater Sci, 2019(54): 8814. DOI:10.1007/s10853-019-03483-y
[35] An H, Xu K Y, Chang L M, et al. Thermo-Responsive Self-Healable Hydrogels with Extremely Mild Base Degradability and Bio-Compatibility[J]. Polymer, 2018(147): 38-47.
[36] Diels O, Alder K. Synthesen in der Hydroaromatischen Reihe[J]. European Journal of Organic Chemistry, 1928, 460(1): 25. DOI:10.1002/jlac.19314900110
[37] Yu F, Cao X D, Du J, et al. Multifunctional Hydrogel with Good Structure Integrity, Self-Healing, and Tissue-Adhesive Property Formed by Combining Diels-Alder Click Reaction and Acylhydrazone Bond[J]. ACS Applied Materials & Interfaces, 2015, 7(43): 24023-24031.
[38] Laura J S, S Maryamdokht T, Roger Y T, et al. Diels-Alder Click-Cross-Linked Hydrogels with Increased Reactivity Enable 3D Cell Encapsulation[J]. Biomacromolecules, 2018, 19(3): 926-935. DOI:10.1021/acs.biomac.7b01715
[39] Yu L, Ding J. Injectable Hydrogels as Unique Biomedical Materials[J]. Chem Soc Rev, 2008(37): 1473-1481.
[40] Zhao X, Li P, Guo B, et al. Antibacterial And Conductive Injectable Hydrogels Based on Quaternized Chitosan-Graft-Polyaniline/Oxidized Dextran for Tissue Engineering[J]. Acta Biomater, 2015(26): 236-248.
[41] Fu S Z, Ni P Y, Wang B Y, et al. Injectable and Thermo-Sensitive PEG-PCL-PEG Copolymer/Collagen/n-Ha Hydrogel Composite for Guided Bone Regeneration[J]. Biomaterials, 2012(33): 4801-4809.
[42] Tseng T C, Tao L, Hsieh F Y, et al. An Injectable, Self-Healing Hydrogel to Repair the Central Nervous System[J]. Advanced Materials, 2015(23): 3518-3524.
[43] Sun J, Guo Y, Xing R, et al. Synergistic In Vivo Photodynamic and Photothermal Antitumor Therapy Based on Collagen-Gold Hybrid Hydrogels with Inclusion of Photosensitive Drugs[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017(514): 155-160.
[44] Abbas M, Xing R, Zhang N, et al. Antitumor Photodynamic Therapy Based on Dipeptide Fibrous Hydrogels with Incorporation of Photosensitive Drugs[J]. ACS Biomaterials Science & Engineering, 2017(6): 2046-2052. DOI:10.1021/acsbiomaterials.7b00624
[45] Xing R, Li S, Zhang N, et al. Self-assembled Injectable Peptide Hydrogels Capable of Triggering Antitumor Immune Response[J]. Biomacromolecules, 2017(18): 3514-3523.
[46] Xing R, Liu K, Jiao T, et al. An Injectable Self-Assembling Collagen-Gold Hybrid Hydrogel for Combinatorial Antitumor Photothermal/Photodynamic Therapy[J]. Adv Mater, 2016(28): 3669-76. DOI:10.1002/adma.201600284
[47] Zhang Y, Zhang H, Zou Q, et al. An Injectable Dipeptide-Fullerene Supramolecular Hydrogel for Photodynamic Antibacterial Therapy[J]. Journal of Materials Chemistry B, 2018(6): 7335-7342.
[48] Bai T, Lius S, Sun F, et al. Zwitterionic Fusion in Hydrogels and Spontaneous and Time-Independent Self-Healing under Physiological Conditions[J]. Biomaterials, 2014(35): 3926-3933.
[49] Lu S, Bai X, Liu H, et al. An Injectable and Self-Healing Hydrogel with Covalent Cross-Linking In Vivo for Cranial Bone Repair[J]. Journal of Materials Chemistry B, 2017(5): 3739-3748.
[50] Landriscina A, Rosen J, Friedman A J. Systematic Approach to Wound Dressings[J]. Journal of Drugs in Dermatology:JDD, 2015(14): 740-744.
[51] Sun J, Guo Y, Xing R, et al. Synergistic In Vivo Photodynamic and Photothermal Antitumor Therapy Based on Collagen-Gold Hybrid Hydrogels with Inclusion of Photosensitive Drugs[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017(514): 155-160.
[52] Zhao X, Wu H, Guo B, et al. Antibacterial Anti-Oxidant Electroactive Injectable Hydrogel as Self-Healing Wound Dressing with Hemostasis and Adhesiveness for Cutaneous Wound Healing[J]. Biomaterials, 2017(122): 34-47.
[53] Chang G, Chen Y, Li Y, Li S, et al. Self-Healable Hydrogel on Tumor Cell as Drug Delivery System for Localized and Effective Therapy[J]. Carbohydr Polym, 2015(122): 336-42.
[54] Qu J, Zhao X, Ma P X, et al. pH-Responsive Self-Healing Injectable Hydrogel Based on N-carboxyethyl Chitosan for Hepatocellular Carcinoma Therapy[J]. Acta Biomaterialia, 2017(58): 168-180.
[55] Yan C, Pochan D J. Rheological Properties of Peptide-Based Hydrogels for Biomedical and other Applications[J]. Chemical Society Reviews, 2010(39): 3528-40.
[56] Yang B, Zhang Y, Zhang X, et al. Facilely Prepared Inexpensive and Biocompatible Self-Healing Hydrogel:A New Injectable Cell Therapy Carrier[J]. Polymer Chemistry, 2012(3): 3235.
[57] Andrew V B, Nowak P, Pakstis Lisa, et al. Rapidly Recovering Hydrogel Scaffolds from Self-Assembling Diblock Copolypeptide Amphiphiles[J]. Nature, 2002(417): 424-428.
[58] Xing R, Liu K, Jiao T, et al. An Injectable Self-Assembling Collagen-Gold Hybrid Hydrogel for Combinatorial Antitumor Photothermal/Photodynamic Therapy[J]. Adv Mater, 2016(28): 3669-76. DOI:10.1002/adma.201600284
[59] Wei Z, Zhao J, Chen Y M, et al. Self-healing Polysaccharide-Based Hydrogels as Injectable Carriers for Neural Stem Cells[J]. Sci Rep, 2016(6): 37841. DOI:10.1038/srep37841

来源:中国药事


