您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-10-15 18:14
牙种植体基台产品注册技术审查指导原则
( 征求意见稿)
牙种植体基台(implant abutment),简称基台(abutment),作为口腔种植修复用医疗器械,是指安装在锚固于骨内的种植体平台上,并将其向口腔内延伸,用于连接、支持和(或)固位修复体或种植体上部结构。牙种植体基台是口腔种植修复的主要植入物之一,其安全性和有效性直接影响口腔修复的效果。本指导原则旨在指导和规范牙种植体基台产品的注册申报工作,帮助申请人理解和掌握该类产品的原理/机理、结构、主要风险、性能、预期用途等内容,用来指导申请人准备和撰写申报资料。同时也可以用于帮助审评人员把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的核心内容是在目前的科技认知水平和现有产品技术基础上形成的。因此,相关人员参考时应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
本指导原则不作为法规强制执行,如有能够满足法规要求的其他方法也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
一、指导原则适用范围
本指导原则适用于 以牙种植体支持式修复为目的,以基台主体、中央螺钉为主要组成的牙种植体基台,包括成品基台和个性化基台。以牙种植体-黏膜支持式修复基台和特殊设计的产品,建议参考本文的技术分析原理来制定适用的具体性能要求及试验方法。
本指导原则涉及的产品所用材料钛及钛合金(Ti6Al4V、Ti6Al7Nb等)及与上述材料实质等同的临床广泛应用的生物材料,对于其他金属材质(不锈钢、钴铬合金、铸造金合金)、陶瓷材质(氧化铝、氧化锆)及其他材料产品,亦可参考本文的技术分析原理来制定适用的具体性能要求及试验方法。
本指导原则适用于境内外产品注册申报,也适用于增加型号规格、改变适用范围的许可事项变更注册。
二、技术审查要点
(一)注册单元的划分
1.注册单元划分原则为:与种植体的不同连接结构(如内连接、外连接)产品应划分为不同的注册单元;组成材料不同的产品应划分为不同的注册单元;不同制作工艺(如成品基台、个性化基台)产品应划分为不同的注册单元;必须联合使用不可分割才能发挥预期用途的产品可以作为一个注册单元申报。
2.型号规格的划分
根据牙种植体基台长轴与牙种植体长轴之间的关系可分为直基台与角度基台;
按照使用功能可分为单牙基台、桥基台、临时基台;
按照固位方式可分为螺丝固位基台和粘接固位基台;
按照临床应用也可以分为实心基台、美学基台、复合基台、研磨基台、按扣基台、球基台等;
个性化基台按照所适配的加工设备、不同种植体系统可分为不同的型号;
此外,一般情况下除尺寸大小差异之外,外形相似的一系列产品可归类为同一型号。
(二)综述资料
1. 概述
1.1申报产品管理类别:Ⅲ类。
1.2分类编码:17(口腔科器械)08(口腔植入及组织重
建材料)02(基台)
1.3产品名称:根据《医疗器械通用名称命名规则》命名,
并详细说明确定依据。
2. 产品描述
2.1全面的器械和操作原理描述
基台通常指连接种植体与修复体的中间结构(Fig.1),相当于常规修复的基牙预备体部分,能够给修复体提供支撑和固位作用,同时基台也具有抗旋转和定位的作用。基台可有一体式、分体式不同表现形式,其中分体式组件可包括基台主体(一段/二段)、中央螺钉等。
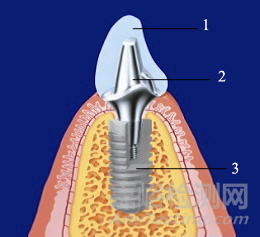
1-修复体 2-基台 3-种植体
Fig. 1 单牙种植修复示意图
基台种类繁多(Fig. 2),分类复杂,可以根据与种植体的连接方式、与上部结构的连接方式、基台组成结构、基台的制作方式、基台长轴与种植体长轴的关系、用途和材料等进行分类。

Fig. 2 不同基台-种植体产品举例
2.1.1基台连接(abutment connection):
基台与种植体的连接方式称之为基台连接。种植体平台中心存在向冠方突起或凹陷到种植体内部的结构设计,分别称为外基台连接(external abutment)和内基台连接(internal abutment connection);依据其几何设计的不同,具体可分为外六角、内三角、内六角、内八角、锥度螺丝、内八角和锥度螺丝、花键、偏轴管状或柱状,以及插槽状接触等。基台种植体与基台的连接设计是骨内种植体的关键环节,理想的基台连接应该具备基台和(或)修复体的固位、抗旋转、定位和应力分散等功能设计,以维持种植体周围骨和软组织结合的长期稳定性。
目前种植体-基台连接界面(implant-abutment interface,IAI)的研究已获得广泛关注,种植体-基台的适合性是种植是影响种植修复体长期使用效果的重要因素之一。
种植体-基台连接界面的几何设计极其关键,是连接强度、连接稳定性、修复体定位和抗旋转的最重要因素。种植体的上部结构在咀嚼力的长期作用下会产生微动,使得种植体与基台之间产生微间隙(microgap,Fig. 3)。现有研究证明,种植体-基台之间的微渗漏会增加软组织炎症的风险,从而增加种植体的边缘骨吸收量及种植体周围炎的发生率。因此,种植体与基台的连接方式可能直接影响到种植体颈部骨组织的稳定性甚至抗感染能力。

Fig. 3 种植体-基台界面图示
2.1.2平台转移(platform switching):
当种植体基台直径小于种植体直径时,基台边缘止于种植体顶部平台的内侧而不是与边缘齐平的设计称为平台转移。当前研究证明,平台转移设计有利于保存种植体颈部骨组织,减少骨吸收,且种植体平台直径与基台直径的差别越大,平台转移减少颈部骨吸收的效果越明显。其可能原因为生物学宽度水平的转移,使种植体-基台界面向种植体长轴方向移动,减少了此处聚集的细菌对边缘骨的影响(Fig. 4)。此外,平台转移亦被认为可改变颈部的应力分布,使应力更集中在种植体中心,减少了种植体周围骨组织的应力。
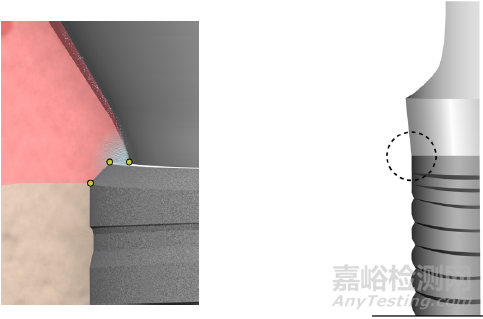
Fig. 4 不同平台连接的差异
2.1.3角度基台(angled abutment)
角度基台的定义为基台长轴与种植体长轴不一致,用于改变种植修复体的长轴方向,改善种植修复体的功能和美学效果。
基台角度通常设计为10o~25o,可以补偿10o~35o的种植体角度倾斜。关于角度基台的临床最大极限角度目前还未有统一的认识,但随基台角度的增大,在斜向加载和轴向加载条件下,种植体骨界面的应力、应变均增大,应力、应变峰值分布从集中于种植体颈部转移至种植体底部,种植体上所受到的水平向剪切力相对较大,对种植体-骨结合破坏趋势增加。因此,在一定程度上讲,角度基台较常规直基台其应力分散作用差。
2.1.4个性化基台(custom abutment):
根据制作方法的不同,基台可分为成品基台和个性化基台。
成品基台亦称预成基台,是厂家直接设计制作,颈缘多为圆柱形的基台,可直接或稍加调磨应用于患者。
个性化基台即定制基台,是根据种植体植入的三维位置、缺牙间隙的三维空间,由医生和(或)技师进行个别调改或制作的基台的总称。个性化基台包括预成可调改基台、可铸造基台及计算机辅助设计/计算机辅助制作(computer-aided design/ computer-aided manufacturing,CAD/CAM)基台。鉴于CAD/CAM基台具有精确度高、穿龈形态好、成本低、耗时短等许多优势,是当前种植修复治疗的趋势。
由于基台是连接种植体与修复体的中间结构,CAD/CAM基台存在下部(与种植体)连接结构、上部(与修复体)修复结构,两处关键可切削部位。
对下部连接结构而言,基台会实现与种植体的连接和固位,包括抗自身旋转功能。种植体-基台连接是固定种植修复中最弱的连接,这是来自咬合的功能作用力转移到种植体平台的关键位置。其对所适配种植体的结构、尺寸、允差等信息需要详细掌握,同时对自身机器切割精度、稳定性也提出了较高要求。
对上部修复结构而言,基台会实现与上部种植修复体的连接和固位,包括抗修复体旋转功能。为兼顾种植修复体的功能和美学要求,骨水平种植系统的基台需考虑肩台设计(包括肩台高度和肩台形状)。CAD/CAM基台的一个重要方面是能够通过计算机辅助设计,快速、精确地按照具体病例的龈缘形态进行肩台设计,达到临床要求。
2.2适用范围和/或预期用途及禁忌症
适用范围:适用于牙种植体的上部修复。
禁忌症:
— 有严重失控的系统疾病、骨代谢紊乱、不可控制的出血性疾病的患者;
— 不合作患者;
— 吸毒、酗酒、吸烟,精神疾病、长期治疗性功能失调的患者;
— 有口干、免疫力低下及白细胞障碍的患者;
— 需定期使用类固醇的疾病、钛过敏、不可控制的内分泌疾病的患者;
— 局部禁忌症:骨量不足,或骨质量较差、局部有残余齿根。
— 相关联禁忌症:骨经过辐照治疗、糖尿病、药物抗凝/出血素质、磨牙症、机能异常习性、复杂解剖的骨形态、烟草的滥用、失控的牙周炎、颞下颌关节疾病、病理颌骨疾病、口腔黏膜异常需要治疗的、孕妇、口腔卫生较差。
申请人亦可根据申报产品的具体预期用途及研究资料,参考本指导原则相关内容要求进一步确认申报产品具体的适用范围及禁忌症,明确适用人群、使用部位和适用的医疗阶段。
(三)产品的研究资料
1、产品的基本信息
1.1产品各型号、各组件、各关键部位的结构图和几何尺寸参数(包括允差)。例如表面处理方式,与牙种植体连接方式,基台主体高度、直径、倾角(如有)及穿龈高度(如有)等。结构图应以产品设计工程图为蓝本明确产品的设计特征。
对有涂层产品应提供有涂层材料的化学成分及涂层自身的化学成分、涂层厚度、涂层表面形态特征、涂层中材料的晶相及非晶相比例及分布、涂层扫描电镜照片等特征。
对个性化基台产品,除以上涉及基本信息应提供外,还应提供对技工室加工切削部位、尺寸范围的详细要求。
1.2符合标准情况
产品各组件及涂层的材料牌号及材料所符合的国家标准、行业标准、国际标准,材料牌号的描述应与其符合的标准一致。进口产品的材料牌号及符合标准同时不应超过原产国上市证明文件/说明书所批准/载明的范围。通常所涉及的材料相关标准包括但不限于:
GB/T 13810 外科植入物用钛及钛合金加工材
ISO 5832-2 Implants for surgery -- Metallic materials -- Part 2: Unalloyed titanium
ISO 5832-3 Implants for surgery -- Metallic materials -- Part 3: Wrought titanium 6-aluminium 4-vanadium alloy
ASTM F136 - 13 Standard Specification for Wrought Titanium-6Aluminum-4Vanadium ELI (Extra Low Interstitial) Alloy for Surgical Implant Applications
GB/T 3620.1-2016钛及钛合金牌号和化学成分
GB/T 3620.2-2007 钛及钛合金加工产品化学成分允许偏差
ASTM F 1472 Standard Specification for Wrought Titanium-6Aluminum-4Vanadium Alloy for Surgical Implant Applications
1.3各型号产品的具体适配系统。即各型号所对应的牙种植体系统,体现不同型号结构组成、几何参数与不同牙种植体的兼容性。
2、产品基本性能研究资料
2.1化学/材料表征
对于种植体基台产品原材料应符合YY/T0520、GB/T13810的要求,按GB/T13810试验方法对系统或组件进行化学成分的测试。
带涂层的产品应明确其涂层原材料及涂层本身化学成分,提供涂层表面化学性能特征。
2.2物理和机械性能
建议生产企业按照YY0315、YY/T0520试验方法对系统或组件进行物理性能的测试。对不予采纳的性能指标或测试方法,生产企业应提供理由及论证。对疲劳极限性能的确定,建议与适配的牙种植体组合,按照YY/T0521试验方法进行并明确具体试验条件,按照行标出具详细的测试报告。
机械性能试验时,考虑预期用途一致的前提下,建议选择“最坏情况”(例如:最大基台角度、最坏加载方向、适配最差牙种植体、容易松动、不稳定或失效系统)对组装后的最终产品进行试验。试验组件应是在设计、机械连接、材料以及制造过程中最恶劣条件下的结构。同时企业应该在试验报告中明确种植体基台组装后作为最恶劣条件的确定依据、试验数据处理合理性的依据。对于许可事项变更注册中增加了组件的产品,如果生产企业认为无需进行系统或组件机械性能测试的,需要说明充足理由。如,新增的组件就是原系统中的一部分、新增组件与其它的部件有着相同的机械连接机制、新增的部件没有减弱系统任何部分的生物力学、新增的部件不会导致系统容易松动或失效等。否则,新增组件的性能应参照YY/T0521进行测试。生产企业应详述选择试验项目的理由。
对于有涂层的产品,建议对涂层后产品的涂层厚度、涂层表面形态特征、表面粗糙度、粘结强度、抗剪切强度、抗压强度、耐磨损性能、疲劳极限等进行表征和/或验证。
对个性化基台产品,应在参考YY0315、YY/T0520标准的基础上,对技工室可进行加工切削的详细结构形态、尺寸范围进行验证。
对与修复体连接的上部修复结构进行切削设计的产品而言,需提供上部修复结构的抗旋结构(如有),可切削尺寸(如基台最薄壁厚、基台最低高度、基台最大角度等),穿龈高度、形态及粗糙度等的详细要求和验证。
对需要与种植体连接的下部连接结构进行切削设计的产品而言,还应同时提供对不同适配牙种植体系统的兼容性验证,如下部连接的结构、形态、尺寸、允差等,包括牙种植体与基台内连接锥度的配合、与种植体界面配合间隙、抗扭性能、紧固扭矩、抗剪切强度、抗压强度。增加切削后产品的机械性能验证。
2.3推荐的产品基本性能试验项目:
外观
尺寸
化学成分(本体及表面、涂层)
显微组织
螺纹偏差
表面缺陷
粗糙度
附着物
抗扭性能
紧固扭矩
抗剪切强度
抗压强度
疲劳极限
配合间隙(锥面间隙、端面间隙)
耐腐蚀性能
内连接锥度配合(若有)
无菌(若有)
细菌内毒素(若有)
3.生物相容性和毒理性评价
牙种植体基台产品生物学评价及毒理性评价依据YY/T 0268、GB/T 16886或ISO 10993系列标准及相关指导原则进行,应当包括:
生物相容性评价的依据和方法;
产品与人体接触的性质;
实施或豁免生物学试验的理由和论证;
对现有数据或试验结果的评价。
具体生物学试验项目建议包括:
细胞毒性
致敏性
急性全身毒性
刺激或皮内反应
遗传毒性
亚急性全身毒性/亚慢性全身毒性(根据产品与人体预期接触
时间确定)
皮下植入
按照国际管理,适用符合GB/T13810标准、且表面未经特殊改性处理的牙种植体基台产品,可申请豁免进行生物相容性试验项目的检测,但应当提交生物相容性评价报告。
4.灭菌性能
生产企业需提供对最终产品灭菌性能及灭菌工艺的完整验证。对于经辐照灭菌的产品,需明确辐照剂量及相关的验证报告,具体的剂量确定依据可参照国标GB 18280或ISO 11137《医疗保健产品-灭菌确认和常规控制要求- 辐射灭菌》。对于经环氧乙烷灭菌的产品,需提供灭菌结果确认和过程控制报告,具体可参照国标GB 18279或ISO 11135《医疗器械-环氧乙烷灭菌-确认和常规控制》。
灭菌验证资料中需要明确灭菌产品主要成分、包装材料、包装工艺及方法;若生产企业提供其他医疗器械产品的灭菌验证资料,则应提供其与本次申报产品在原材料、灭菌方法、灭菌剂量、包装材料、包装工艺、包装方式及其它影响阻菌性能的因素方面具有等同性的证明资料。
对包含的不同涂层成分、不同包装、不同灭菌方式的产品应分别提供验证资料。
非灭菌包装的终产品,应明确推荐采用的灭菌方法并提供确定依据,建议根据WS310.2医院消毒供应中心-第2部分-清洗消毒及灭菌技术操作规范。
5.产品有效期和包装研究
产品有效期的确定应该建立在科学试验的基础上,如稳定性试验,其目的是考察产品在温度、湿度、光线的影响下随时间变化的规律,为产品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立产品的有效期。因此,生产者在申报产品注册时应提供产品有效期(包括产品性能稳定性和无菌状态持续性的保证期限)的验证报告及内包装材料信息;若产品无有效期要求,也应当阐述无有效期要求的理由。
灭菌产品应参照《无源植入性医疗器械货架寿命申报资料指导原则》提供产品有效期(货架寿命)的验证资料。需提供加速老化试验或/和实时老化试验报告。加速老化试验中应明确试验温度、湿度、加速老化时间的确定依据;老化试验后需要对包装完整性和包装强度的评价试验,如染色液穿透试验、真空泄露试验、微生物屏障试验、材料密封强度试验、模拟运输等。
6、动物试验研究
对于使用了新材料、新技术、新设计或具有新作用机理、新功能的牙种植体基台产品应提供申报产品的动物实验研究。建议根据产品预期用途在适合的动物模型中进行产品的性能评价。动物实验应与产品临床使用部位和使用方法相适应,至少应包括:
模型选择的依据;
研究中使用的治疗参数与建议用于人体的治疗参数的比较;
实验方案和方法;
结果(包括原始数据样本);
结论。
7、其他
申请人认为在研究中应提交的证明产品安全有效所必需的其他材料。
(四)产品的风险管理资料
根据YY/T 0316《医疗器械风险管理对医疗器械的应用》,充分识别牙种植体基台的设计、原材料、生产加工、包装、灭菌、运输、贮存、使用等生命周期内各个环节的安全特征,从能量危害(若涉及)、生物学危害、环境危害、有关使用的危害、因功能失效、老化及存储不当引起的危害等方面,对产品进行全面的风险分析,并详述所采取的风险控制措施及验证结果,必要时应引用检测和评价性报告。
牙种植体基台产品常见失效模式有:中央螺钉变形、松动、断裂,基台变形或断裂,与牙种植体兼容性差(螺钉难以就位,基台主体难以插入、难以拆卸、卡塞,结构、尺寸不充分……),说明书/标签信息不充分、不准确引起的误用,未密封的产品包装,未灭菌产品放行,无菌屏障系统失效等。
提供产品上市前对其风险管理活动进行全面评审所形成的风险管理报告,此报告旨在说明并承诺风险管理计划已被适当地实施,并经过验证后判定综合剩余风险是可接受的,已有恰当的方法获得产品相关、出厂后流通和临床应用的信息。
风险管理报告应包括风险分析、风险评价、风险控制等产品风险管理的相关资料,至少应包括产品安全特征清单、产品可预见的危害及危害分析清单(说明危害、可预见事件序列(即危害成因分析))、危害处境和可能发生的损害之间的关系、风险评价、风险控制措施以及剩余风险评价汇总表。
风险管理报告可参照附录《牙种植体基台产品风险管理资料要求》进行编制。
(五)产品技术要求
应按照医疗器械产品技术要求编写指导原则进行编写。
若引用国家标准、行业标准或中国药典,应注明相应标准的编号和年号以及中国药典的版本号。
对同一注册单元中存在多种型号和/或规格的产品,应明确各型号及各规格之间的所有区别,并附相应图示及数据表格对逐型号规格进行说明。
性能指标及检验方法的确定是技术要求的主要内容,性能指标的制定应参考相关国家标准/行业标准并结合具体产品的设计特性、预期用途和质量控制水平,且性能指标不应低于产品适用的强制性国家标准/行业标准,检验方法应优先考虑采用公认的或已颁布的标准检验方法,包括推荐性标准。若需要修改公认的标准检验方法以匹配产品的设计特点或具体使用方式,例如特殊工装及测试样品的制备方法,应详细论证检验方法及测试结果可接受限的合理性。若原材料的化学成分、显微组织等技术要求经加工后仍适用于终产品,则可以列入性能指标。除非原材料的力学性能与成品的力学性能要求一致,否则产品技术要求中力学性能指标应针对终产品而不包括针对原材料的内容。
(六)产品注册检验
产品的全性能指标的注册检验报告应由符合注册管理办法要求的检测机构出具,包括对产品技术要求的预评价报告。送检样品除符合抽样原则外,需注意其对所有申报型号规格的代表性。这里的代表性在力学测试方面与产品技术资料中所论述的“典型性”、“最坏情况”意义相同。具有涂层的产品应优先作为典型性产品。除产品(包括涂层)的力学性能最差情况外,其它理化特性的典型性应同时考虑加工工艺与组件结构的复杂性。
(七)产品的临床研究资料
申请人应按照《医疗器械注册管理办法》、《医疗器械临床评价技术指导原则》选择合理的临床评价方式,提交临床评价资料。鉴于基台与种植体密切配合、不可分割地发挥预期用途,仍然推荐以牙种植体系统进行临床评价和必要时开展临床试验,但企业应更加关注特别由基台产品引起的临床使用风险。
1.对于使用符合GB/T 13810要求的植入钛、钛合金材料,器械表面未经特殊改性处理, 且结构设计与已上市同类产品实质等同的标准品直型基台产品,可申请豁免临床试验,但应提交临床评价资料。
2.临床试验基本要求
在中国境内开展临床试验的产品应符合《医疗器械临床试验规定》及本指导原则的要求。需要与相适配的牙种植体组合使用,开展临床试验。应对产品是否满足使用要求或者适用范围进行确认。提交的临床评价资料应当包括临床试验协议、临床试验方案和临床试验报告等。考虑牙种植体(系统)临床试验的特殊性,可不设置对照组,而采用国际公认的评价标准来判定是否种植成功。
评价标准为:临床检查种植体无松动;X线片检查种植体周围无透光区,种植体植入术后第一年垂直骨吸收小于2.0mm,以后每年复查垂直骨吸收小于0.2mm;种植后无持续性和(或)不可逆的症状及体征,如疼痛、感染、神经过敏、感觉异常及神经管损伤等;修复后美学效果满意。
对牙种植体基台的临床试验,还应当关注并记录种植体及其基台破损及松动、种植体周围骨吸收、种植体断裂、感染情况等不良事件,并且对所有不能随访受试者做出详细解释。
牙种植体基台的临床试验主要包括以下6个方面的资料:
2.1受试者纳入标准及排除标准
应当在临床研究方案中规定完善合理的受试者纳入标准及排除标准,建议参照YY/T 1305《钛及钛合金牙种植体临床试验指南》。临床试验建议选择进行单冠种植修复的病例,并应当根据下列因素对受试者进行描述:预期用途、试验组人数、性别及年龄分布、牙列状况、咬合情况、牙槽突的骨量和骨质、使用辅助材料情况等,并对前述的重要非试验因素的取值范围作出明确的规定。
确定样本含量的基本原则:应当给出具体的计算公式和公式的出处,并根据下列五个方面确定所需要的样本含量,即①拟采取的试验设计类型;②主要评价指标的性质(若采用单组设计,应当根据当前本领域内国内外公认的种植体种植成功评价标准给出主要评价指标的标准值);③拟采取的比较类型;④应当明确给出允许犯假阳性错误的概率α(α通常不超过0. 05)和犯假阴性错误的概率β(β通常不超过0. 2,1-β被称为检验效能或把握度);⑤应当考虑20%以内的脱落率。
各中心参与研究人员应当接受统一的专业培训;对结果评价有重要影响的试验或指标的检测应当由一个有资质的中心试验单位来完成,以消除中心效应对结果的影响。
2.2植入前评估
临床方案中植入前评估应当包含:受试者的全身状况、影响试验结果的任何疾病情况及受试者口腔状况、预植入的部位、特殊条件下种植体的植入(如IV 类骨或上颌窦区域的种植等)、各种病理状况(如感染、出血及炎症等)、对颌部位的牙齿、口腔卫生状态、植入部位的骨质骨量。
植入前评估应当包括种植体植入部位的标准化X 线片/CT片,定量分析牙槽嵴的骨高度及宽度,使用X 射线机拍片评估种植部位骨状况,研究期间所拍摄的X-光片/CT 片应当具有可比性。该步骤还可在植入后评估中应用。适合的影像学检查结果包括:全景X-光片/CT 片、根尖X-光片/CT 片等。
2.3植入中观察
2.3.1术前准备
应当记录患者术前牙周治疗情况、抗生素及漱口液使用情况、局麻患者常规心电监护等。
2.3.2术中观察项目
应当观察并记录手术消毒方式、麻醉方法、切口方式、植入部位牙槽骨解剖状态、种植体类型及基本参数、种植方式、种植体植入后初期稳定性、是否植骨(植骨的材料和方式)、种植体植入后位置、软组织瓣缝合状态、手术中器械使用的顺应性等。
2.3.3术后观察项目
应当观察并记录术后的用药情况(包括用药方式、剂量、时间),术后7天、14天伤口愈合情况及术后即刻、3 个月X 线
片观察种植体愈合情况,试验后种植区域有无疼痛、感染症状或感觉过敏、感觉异常等神经损伤症状。
2.3.4植入后评估
临床方案中植入后评估应当包含:
临床及影像学评估频率
应当说明临床评估及影像学评估的次数、频率。临床观察的时间点通常为种植咬合负重完成后1个月、3个月、6个月、1年。对于配合以下5类种植体:
a.与已上市器械有不同材料组成及设计的种植体;
b.长度小于7mm 和(或)直径小于3. 25mm 的种植体;
c.采用了新技术的种植体;
d.预期用途有异于同类器械的种植体;
e.表面有涂层的种植体(表面处理方法符合《牙种植体(系统注册技术审查指导原则)》的相关要求);
和/或牙种植体基台本身具备以下5类特征:
a.与已上市器械有不同材料组成及新设计的基台;
b.角度大于30°的基台;
c.采用了新技术的基台;
d.预期用途有异于同类器械的基台;
e.表面有涂层的基台(表面处理方法符合本指导原则的相关要求)
需继续进行6个月上市后随访,建议累计试验观察点为1个月、3个月、6个月、12个月、18个月。
植入期各阶段的时间间隔
应当指明在治疗各个阶段之间的时间间隔(例如:牙种植体植入后到基台植入前;种植体植入后到咬合面受力之前)。临床试验观察期是从种植体承受咬合力开始,应当按临床研究方案中的要求描述咬合负重(功能性负重、非功能性负重或渐进性负重) 情况。
2.4研究过程的药物治疗
应当记录在临床研究期间任何可影响研究结果的药物治疗及服用/使用剂量,如抗生素、止痛剂、漱口水之类的用药情况均需记录。
影像学资料
应当获取方案中提及的影像学资料。应当依据影像学资料定量分析牙槽嵴吸收情况;还应当记录种植体周围X-线透射的影像学证据。
植入后评估除上述四项外,临床评价指标还包括:种植体周围软组织健康、牙齿及植入体活动度、种植体周围软组织袋探诊深度及术后并发症。
2.5不良事件和并发症
应当对每项不良事件及并发症进行描述并制表,应当包括如下事件:感染、种植体修复前脱落、种植体破损或断裂、种植体修复后脱落、基台螺丝松动或折断、疼痛、感觉异常等与牙种植体基台相关不良事件。应当提供失去随访的受试者数目、原因及失访时间。对每例不良事件,应当提供详细完备的事件分析报告。
2.6数据制表及统计分析
应当对所有受试者报告表中的数据进行制表,包括未完成调查受试者资料的副本,将临床试验数据进行统计分析,记录统计分析的方法及结果。应当根据试验设计类型、比较类型、资料性质和统计分析目的,合理选择统计分析方法,并对所用的统计学方法,必须引用参考目录或列出公式,并对任何变更进行解释。
(八)产品说明书、标签和包装标识
产品说明书、标签和包装标识应符合国家食品药品监督管理总局发布的《医疗器械说明书和标签管理规定》要求,还应符合相关国家标准、行业标准的要求,例如YY/T0466.1《用于医疗器械标签、标记和提供信息的符号》。
产品临床适用范围/适应证、禁忌症、并发症、注意事项等内容应与临床试验所验证的范围一致。
产品有效期、采用的灭菌方法、非灭菌产品推荐采用的灭菌方法、存储运输条件等信息应与产品研究资料所述一致。
(九)产品生产工艺和过程控制
1.详述产品的生产过程,提供生产工艺流程图。
2.明确特殊过程和关键工艺,提供特殊过程的确认资料以及关键工艺的验证资料。明确关键质量控制指标及相关验证报告。
3.对上部修复结构进行加工的产品,申请人应提供对适配的扫描设备、软件设备及加工成型设备的验证;对下部连接结构进行加工的产品,申请人还应提供针对下部连接结构加工成型设备的验证报告,明确其加工精度及稳定性验证。
4.明确生产过程中各种加工助剂的使用情况(如起始浓度、去除措施、残留浓度、对残留量的控制标准、毒性信息等)及对杂质(如残留单体、小分子残留物等)的控制情况。例如表面涂层工艺过程中各类加工助剂的添加、去除和残留控制。产品加工过程的常见助剂有切削液、冷却液、润滑剂、抛光剂、清洁剂等。对于有阳极氧化表面处理的钛及钛合金材质产品,尤其灰黑色微弧阳极氧化,应明确氧化层引入的与基体材料不一致的新元素的质控措施,并通过适当的表面元素分析方法(如半定量定性分析)来评估该工艺的稳定性。
如申报产品有多个研制、生产场地,应概述每个研制、生产场地的概况。
三、参考文献
1、《医疗器械监督管理条例》(中华人民共和国国务院令第650号)
2、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
3、《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)
4、《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)
5、《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局2015年第14号通告)
6、《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局2014年第43号)
7、YY/T 0316《医疗器械 风险管理对医疗器械的应用》
8、《无源植入性医疗器械产品注册申报资料指导原则》(食药监办械函[2009]519号文)
9、《无源植入性医疗器械货架寿命申报资料指导原则》(食药监办械函[2011]116号文)
10、《牙科种植体(系统)注册技术审查指导原则》(2016年第70号)
四、编写单位
本指导原则由国家药品监督管理局医疗器械技术审评中心起草并负责解释。
附件:
牙种植体基台产品风险管理资料要求
一、总体要求
生产企业应提供产品上市前对其风险管理活动进行全面评审所形成的风险管理报告以及相关的产品风险管理资料。该风险管理报告应说明:(1)风险管理计划已被适当地实施;(2)综合剩余风险是可接受的;(3)已有恰当的方法获得与本产品相关和出厂后流通与临床应用的信息。
除此之外,风险管理报告还应扼要说明:(1)在产品研制的初期阶段,对风险管理活动的策划及所形成的风险管理计划;(2)说明已识别了产品有关的可能危害,并对其危害产生的风险进行了估计和评价;(3)在降低风险措施方面,考虑了相关安全标准和相关产品标准,并有针对性地实施了降低风险的技术和管理方面的措施;(4)通过产品的成分、性能等测试、生产工艺的确认及验证、相关文件的审查、试生产等活动对风险控制措施的有效性实施验证;(5)生产企业应对产品的安全性做出承诺。
风险管理报告应由生产企业的最高管理者(法人)或其授权的代表签字批准。
二、风险管理报告及风险管理资料内容
1.职责权限
生产企业应明确参与风险管理活动的成员,包括风险分析人员、风险评价人员、风险控制措施制定人员及验证人员、风险管理过程评审人员以及风险管理报告的编制及审批人员,他们可能是同一组人,应列出其姓名、职务及责任范围。其成员应具有与风险管理任务相适应的知识和经验。
2.产品描述
2.1通过照片、结构图、图表和文字描述等形式表征产品的型号规格、组件以及关键部位;
2.2各组件的材料牌号;
2.3各型号产品的具体适用部位;
2.4生产工艺流程;
2.5适用的国家标准、行业标准、国际标准;
3、产品的安全特征判定
生产企业应按照YY/T0316《医疗器械 风险管理对医疗器械的应用》附录C提示的问题,针对实际情况对产品的安全特征作简明描述。产品如存在附录C提示以外的可能影响安全特征的情况,也应做出说明。最终形成一份《产品安全特征清单》。
4、产品的可能危害判定
生产企业应在《产品安全特征清单》的基础上,系统地判定产品在正常和故障两种条件下的可预见危害。并对危害的成因及后果进行分析,即说明危害、可预见事件序列、危害处境和可能发生的损害之间的关系。形成一份产品可预见的危害及危害分析清单。
5、对危害清单中每一危害处境下的风险进行风险估计和风险评价
生产企业应明确风险可接受准则,并对损害发生的概率和损害的严重程度予以明确定义;产品国家标准、行业标准中如涉及了相关风险的可接受准则,该准则应作为生产企业所确定的风险可接受准则之一,除非有证据证实其特定风险的可接受准则不必符合相关标准。生产企业应依据风险可接受准则对危害清单中每一危害处境下的风险进行风险估计和风险评价。
风险评价的结果可以记入《风险评价、风险控制措施以及剩余风险评价汇总表》中。
6、降低风险的控制措施
生产企业应对经风险评价后不可接受的或考虑可进一步采取措施降低的风险实施降低风险的控制措施。在制定降低风险的控制措施方案时,应充分考虑产品国家标准、行业标准中有关降低风险的措施。应确保降低风险的控制措施在研制初期得到有效的输入,并应对措施的有效性实施验证。
7、生产企业应对采取降低风险的控制措施后的剩余风险以及是否会引发新的风险进行评价。
以上降低风险的控制措施、控制措施的验证、剩余风险评价等信息可以记入《风险评价、风险控制措施以及剩余风险评价汇总表》中。
8、结论
生产企业应对综合剩余风险是否可接受给出结论性意见,并对已有恰当的方法获得与本产品相关和出厂后流通与临床应用的信息进行阐述并做出承诺。

来源:Internet


