您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-10-14 16:39
作 者:李妍达
单 位:北京市医疗器械检验所
〔摘要〕IEC 61010-2-101 适用于预期用作体外诊断(IVD)医用目的,包括自测 IVD 医用目的的设备。为了更好地理解和使用 IEC 61010-2-101:2015 国际标准,本研究介绍了该标准的背景,以及 2015 版 与 2002 版在技术要求上的主要变化。
在世界人口老龄化趋势背景下,不断增长的患病人数使医疗诊断的需求激增,随之而来的是体外诊断(in vitro diagnostic,IVD)行业的飞速发展[1]。基于 IVD 设备预期用途的特殊性,操作人员频繁面对各类人体样本、危险化学试剂等,操作设备时,存在较高的生物化学风险和机械危险[2]。为此,IEC/TC66 组织并撰写了国际标准 IEC 61010-2-101《测量、控制和实验室用电气设备的安全要求第 2-101 部分:体外诊断 (IVD) 医用设备的专用要求》。
1、IEC 概述
2、标准背景介绍
为保护 IVD 设备操作人员的人身安全,IEC/TC66 于2002 年,编写了国际标准 IEC 61010-2-101 :2002《测量、控制和实验室用电气设备的安全要求第 2-101 部分:体外诊断 (IVD) 医用设备的专用要求》,预期用作 IVD 医用目的医用实验室仪器要求执行的安全标准,结合 IEC 61010-1 一起使用。防止操作人员由于操作设备可能产生的生化、电气和机械等危险。
3、适用范围变化
4、技术要求变化
表 1 符号
第 7 章中增加了对操作人员维护说明和对样品区和加载区的要求,在 2002 版标准中没有提到样品区和加载区的概念,2015 版修订后,增加了相关的定义和要求,提高了标准的安全性和有效性。
根据 IEC61010-1 :2010 修订后的变化,第 8 章跌落试验相应增加了不包含尺寸和重量使得其不可能无意间移动的设备的要求。
第 13 章中增加了对生物风险标识的要求。
第 15 章增加对电气/电子或可编程的元器件的联锁系统的要求,规定其可靠性和设计要求能够通过采用例如 IEC 62061(SIL)或 ISO 13849(PL)或其他提供同等功能安全性的方案进行确定。
增加了第 16 章应用引起的危险,在条款 16.2 人体工程学方面中提出可参考 IEC 62366,EN 894-2,EN 894-3,ISO 9241,SEMI S8 和其他文件进行风险评定程序。
增加了第 17 章,提出本部分和 IEC61010-1 中未涉及的危险,应按照 ISO 14971 的要求开展风险评定并文件化。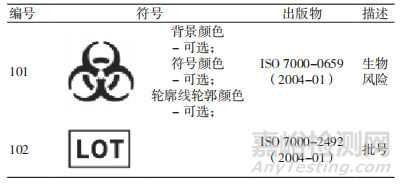
5、主要技术要求变化详述
5.1 自测 IVD 医用设备的使用说明
5.2 电气/电子或可编程的元器件的联锁系统可靠性和设计要求
新版标准在第 15 章中要求评估电气 / 电子或可编程的元器件的联锁系统可靠性和设计要求,评估方案可依照IEC62061(SIL)或 ISO 13849(PL)进行。
IEC 62061 是由国际电工委员会(IEC)制定并发布,适用于机械领域非便携式机器设备的国际功能安全标准,其中文名称是《机械安全 - 与安全有关的电气、电子和可编程电子控制系统的功能安全》,仅用于设计、整合和验证电气安全系统,并提出建议和具体要求,以降低人直接操作机器时产生的伤害,对于非电气控制元件(液压,气动)的性能没有相关要求。
ISO 13849 是 ISO(国际标准化组织)颁布的标准,其中文名称是《机械安全 - 控制系统地安全相关部分》,侧重于分析控制电路的结构,不仅可用于电气、电子和可编程电子控制系统,还对机械、液压、气动系统提出相应安全要求,为设计人员研发设备,对控制系统的功能安全提供了指导和依据。
根据上述内容可以看出,IEC62061 适合用于评估相对复杂的电子系统,不适用于设备非电气安全相关控制部分的评估;ISO 13849 适用于简单控制系统的机械设备,在电子 / 电气、机械、液压、气动等领域均适用,应用范围较IEC 62061 更广。
6、小结
【参考文献】
[1]张建国 . 浅谈机械安全 -E/E/PE 控制系统的功能安全标准 IEC 62061[J]. 中国仪器仪表,2009(5):49-55.
[2]牛道森, 刘晓东, 刘梦 . 机械 SRECS 的功能安全要求与评估 [J]. 中国仪器仪表, 2015(5):48.

来源:医疗装备


