您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-01-07 15:21
2018年12月医药行业法规总结
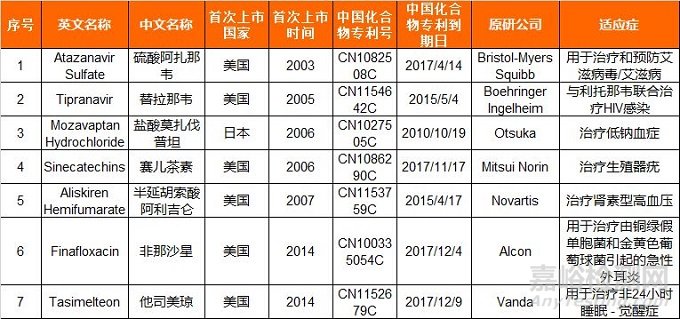
药审中心关于征求《第二批专利权到期、终止、无效且尚无仿制申请的药品清单》意见的通知
国食药监总局药审中心对国内化合物专利权到期、终止、无效且尚无仿制申请的国外已上市药品进行筛选,初步筛选出硫酸阿扎那韦等7个具有明确临床价值的药品,拟纳入《第二批专利权到期、终止、无效且尚无仿制申请的药品清单》
<< 第二批专利权到期、终止、无效且尚无仿制申请的药品清单 >>
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314770
关于《塑料和橡胶类药包材自身稳定性研究指导原则》(第二次征求意见稿)的公示
根据2016年度药品医疗器械审评审批制度改革相关研究课题的设立,国家药典委员会组织有关单位草拟了《塑料和橡胶类药包材稳定性研究指导原则》。2018年7月结合反馈意见形成了第二次征求意见稿,现再次向社会公开征求意见,公示期三个月。
法规链接:http://www.chp.org.cn/view/ff80808166ed5beb0167aa865d0743c7?a=BZYBC
关于《中国药典》2015年版(三部)
血液制品拟增修订内容公示
国家药典委员会对《中国药典》2015年版(三部)血液制品增修订内容进行公示,内容包括:
各论品种拟增修订项目及内容
拟增订通则 3428 人免疫球蛋白类制品IgA残留量测定法
拟增订品种:猪纤维蛋白粘合剂
法规链接:http://www.chp.org.cn/view/ff80808166ed5beb016771addf3f4b49?a=BZSWZP
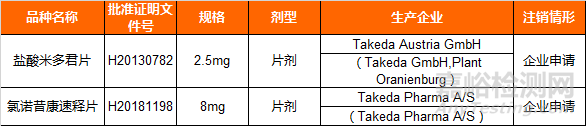
关于注销盐酸米多君片等2个药品批准证明文件的公告(2018年第95号)
根据《中华人民共和国药品管理法实施条例》和《药品注册管理办法》的有关规定,国家药品监督管理局决定注销盐酸米多君片等2个药品批准证明文件。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/333825.html
国家药品监督管理局关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)
为进一步做好一致性评价工作,经国务院同意,现就有关事项公告如下:
一、严格评价标准,强化上市后监管
二、时间服从质量,合理调整相关工作时限和要求
三、强化服务指导,全力推进一致性评价工作
四、加强配套政策支持,调动企业评价积极性
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/334161.html
国家药监局关于加强药品集中采购和使用试点期间
药品监管工作的通知
一、深刻认识试点工作重要意义
二、加强药品生产监管
三、加强药品流通使用监管
四、加强药品抽检和不良反应监测
五、加快推进一致性评价工作
六、实施创新驱动发展战略,助推药品高质量发展
七、工作要求
法规链接:http://www.nmpa.gov.cn/WS04/CL2196/334097.html
国家药监局关于停止生产销售使用
吡硫醇注射剂的通知
一、请各省(区、市)药品监督管理部门加强对相关药品生产企业的监督检查,督促企业排查药品销售流向,确保已上市销售药品于2019年1月15日前全部召回,并予以监督销毁。
二、督促本行政区域内药品经营企业、使用单位落实停止销售和使用的措施,并配合做好产品召回工作。
法规链接:http://www.nmpa.gov.cn/WS04/CL2196/334185.html
关于发布个例药品不良反应收集和报告指导原则的通告(2018年第131号)
本指导原则适用于上市许可持有人(包括持有药品批准证明文件的生产企业,以下简称持有人)开展个例药品不良反应的收集和报告工作。
国务院卫生行政部门和药品监督管理部门对疫苗不良反应收集和报告另有规定的,从其规定。
本指导原则中个例药品不良反应是指单个患者使用药品发生的不良反应。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/334011.html
国家药品监督管理局关于发布仿制药参比制剂目录(第十九批)的通告(2018年第135号)
经国家药品监督管理局仿制药质量与疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第十九批)。
其中包括赛诺菲的盐酸阿夫唑嗪缓释片、阿斯利康的沙格列汀二甲双胍缓释片(II)等原研进口药。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/334183.html
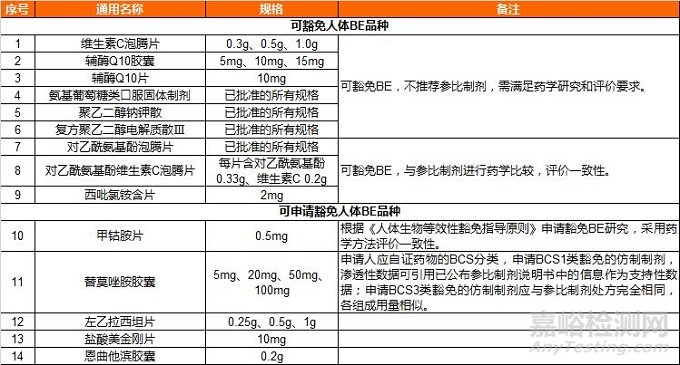
国家药品监督管理局关于发布可豁免或简化人体生物等效性(BE)试验品种(第二批)的通告(2018年第136号)
仿制药质量与疗效一致性评价办公室经调研论证和征求意见,确定了可豁免或简化人体生物等效性(BE)试验品种(第二批)(见附件),现予发布。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/334184.html
关于公开征求24个ICH指导原则中文翻译稿意见的通知
为推动ICH指导原则在我国的转化实施,国家药品监督管理局药品审评中心组织翻译ICH指导原则,现对24个ICH指导原则中文翻译稿公开征求意见
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314775

来源:SGS


