您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-07-23 20:42
摘 要: 建立超声破碎提取-硅胶净化-气相色谱-三重四级杆质谱法测定茶叶中的多环芳烃。以正己烷-丙酮(体积比为1∶1)为溶剂,采用超声波提取法对样品进行提取,提取温度为40 ℃,提取时间为10 min。提取液经硅胶固相萃取柱净化,用二氯甲烷-正己烷(体积比为2∶8)混合溶液洗脱。样品溶液用HP-5 ms毛细管柱(30 m×0.25 mm,0.25 µm)分离,采用多反应监测模式扫描,内标法定量。16种多环芳烃的质量浓度在1~500 μg/L范围内与色谱峰面积具有良好的线性关系,相关系数均不小于0.998。方法检出限为0.32~0.64 μg/kg,定量限为1.28~2.56 μg/kg。实际样品加标平均回收率为62.2%~117.6%,测定结果的相对标准偏差2.7%~10.8% (n=6)。该方法满足茶叶中多环芳烃化合物的分析要求。
关键词: 超声破碎提取; 硅胶净化; 茶叶; 多环芳烃; 气相色谱-三重四级杆质谱
多环芳烃(PAHs)是指两个以上苯环以稠环形式相连的化合物,具有急性毒性、遗传毒性、致癌致畸性、光致毒性[1],是目前环境中普遍存在的污染物质。随着大气循环,PAHs在大气、土壤、水和植物之间相互扩散,已被世界各国列为优先控制的环境污染物[2]。我国2005年和2015年分别开展的“全国土壤污染状况调查”和“全国农用地土壤污染状况详查”均将多环芳烃列为重点污染物监测对象。随着经济的高速发展,多环芳烃污染不容忽视。茶叶是我国传统饮品,也是我国重要的经济作物和出口创汇农产品。茶叶生长周期长,在种植、加工阶段不可避免受到PAHs污染[3‒5]。
多环芳烃的测定方法主要有高效液相色谱法[[6‒7]和气相色谱-质谱法[8‒10]。液相色谱法紫外检测器和荧光检测器灵敏度高,但由于其分离能力的限制,容易受到基质干扰,从而无法实现准确定量。气相色谱-质谱是一种定性定量分析多环芳烃类物质的重要手段,其优势是定性准确,在不能完全将干扰物分离的情况下仍可以准确定量。而气相色谱-三重四级杆质谱特有的多反应监测模式,与常规的全扫描模式和选择离子监测模式相比具有灵敏度更高、重现性更好、准确性更高和抗基质干扰能力更强等优势。茶叶中的多种色素会造成严重的基质干扰,无论是采用液相色谱方法或者是气相色谱-质谱联用方法都需要考察基质干扰[11],由于不容易找到合适的茶叶空白基质,样品的净化尤为重要。通过净化可以有效去除色素,净化后的样品采用多反应监测模式检测,可以尽可能降低基质干扰。笔者分别考察了提取溶剂、提取温度、固相萃取净化柱的选择、混合洗脱液的比例等因素,对茶叶样品提取、净化方法进行优化,同时对气相色谱-三重四级杆质谱参数进行优化,在此基础上建立了超声破碎提取-硅胶净化-气相色谱-三重四级杆质谱测定茶叶中多环芳烃的方法。
1 实验部分
1.1 主要仪器与试剂
气相色谱-质谱联用仪:GCMS TQ-8040型,日本岛津公司。
超声波多通道粉碎机:Scientz-6TD型,宁波新芝生物科技股份有限公司。
旋转蒸发仪:RE-52A型,上海亚荣生化仪器厂。
固相萃取装置:SBEQ-CG1012型,上海安谱科技有限公司。
硅胶固相萃取净化柱:CNWBOND Si SPE Cartridge型,1 g,6 mL,上海安谱科技有限公司。
正己烷、二氯甲烷、丙酮:均为色谱纯,上海安谱科技有限公司。
16种多环芳烃混合标准溶液:萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、![]() 、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、茚并[1,2,3-c,d]芘、二苯并[a,h]蒽、苯并[g,h,i]苝的质量浓度均为2 000 mg/L,批号为631004,上海安谱科技有限公司。
、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、茚并[1,2,3-c,d]芘、二苯并[a,h]蒽、苯并[g,h,i]苝的质量浓度均为2 000 mg/L,批号为631004,上海安谱科技有限公司。
5种氘代多环芳烃混合标准溶液:萘-d8,苊烯-d10、菲-d10、![]() -d12、苝-d12的质量浓度均为2 000 mg/L,批号为112516,上海安谱科技有限公司。
-d12、苝-d12的质量浓度均为2 000 mg/L,批号为112516,上海安谱科技有限公司。
茶叶样品:市售。
1.2 溶液的配制
内标使用液:各组分质量浓度均为10.0 mg/L。在装有适量正己烷的10.00 mL容量瓶中,加入5种氘代多环芳烃混合标准溶液50.0 μL,用正己烷定容至标线,摇匀。
16种多环芳烃混合标准使用液:各组分质量浓度均为1.00 mg/L。在装有适量正己烷的50.00 mL容量瓶中,加入16种多环芳烃混合标准溶液25.0 μL,用正己烷定容至标线,摇匀。
16种多环芳烃系列混合标准工作溶液:取7只5 mL容量瓶,预先加入2 mL正己烷,分别加入适量的16种多环芳烃混合标准使用液,用正己烷定容至标线,摇匀,配制成16种多环芳烃的质量浓度均分别为1.00、5.00、10.0、50.0、100、200、500 μg/L,内标质量浓度均为200 μg/L的系列混合标准工作溶液。
1.3 仪器工作条件
1.3.1 气相色谱仪
色谱柱:HP-5 ms型石英毛细管柱(30 m×0.25 mm,0.25 µm,美国安捷伦科技有限公司);载气:高纯氦气,体积分数为99.999%;柱流量:1.0 mL/min;进样口温度:250 ℃;进样体积:1.0 µL;进样方式:不分流进样;程序升温:初始温度为50 ℃,以20 ℃/min升温至150 ℃,保持2 min,再以12 ℃/min升温至290 ℃,保持15 min。
1.3.2 质谱仪
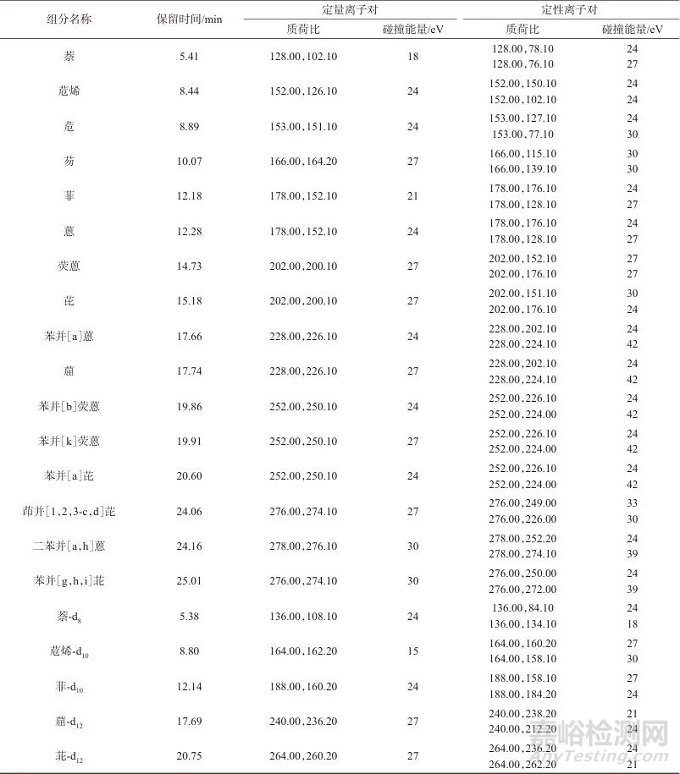
电子轰击源:EI源;离子化能量:70 eV;离子源温度:230 ℃;传输线温度:250 ℃;扫描模式:多反应监测(MRM)模式;四级杆温度:150 ℃;溶剂延迟时间:4.5 min;16种多环芳烃化合物和5种氘代多环芳烃内标的保留时间和质谱参数见表1。
表1 16种多环芳烃化合物和5种氘代多环芳烃内标的保留时间和质谱参数
Tab. 1 Retention time and mass spectrometry parameters of 16 polycyclic aromatic hydrocarbon compounds and 5 deuterated polycyclic aromatic hydrocarbon internal standards
1.4 实验方法
1.4.1 样品提取
称取2.00 g粉碎的茶叶样品,置于50 mL离心管中,加入10 mL正己烷-丙酮(体积比为1∶1,下同)混合溶液,在40 kHz频率下用超声波提取器提取10 min,提取温度为40 ℃。以4 000 r/min转速离心5 min,上清液转移至100 mL的平底烧瓶中,再次加入10 mL正己烷-丙酮混合溶液进行二次超声提取,提取10 min,离心后,合并上清液,经无水硫酸钠脱水后,在40 ℃旋转蒸发仪中浓缩近干,加入5 mL正己烷溶解,待净化。
1.4.2 净化、浓缩、定容
用5 mL二氯甲烷冲洗硅胶固相萃取柱,待液面即将降至柱子固体填充层时,立即加入5 mL正己烷,平衡柱子。待柱子充满正己烷后关闭流量控制阀,浸润5 min,打开控制阀,弃去流出液。将浓缩后的茶叶样品提取液转移至柱内,用3 mL正己烷分3次洗涤平底烧瓶,洗液全部移入柱内,待样品提取液和洗液全部通过萃取柱后,用5 mL二氯甲烷-正己烷(体积比为2∶8)混合溶液洗脱萃取柱,收集全部过柱的洗脱液,氮吹浓缩至近干,用正己烷定容至1.0 mL,加入内标使用液20 µL,即为样品溶液。
1.4.3 定量方法
按1.3仪器工作条件,对16种多环芳烃系列混合标准溶液从低浓度到高浓度依次进样分析,以各目标化合物的质量浓度为横坐标,以对应的色谱峰面积为纵坐标,绘制标准工作曲线。将数据处理软件定量参数中定量方法设置为内标法,曲线拟合类型选择线性。软件自动计算样品溶液中多环芳烃的质量浓度,再依据称样质量、定容体积及稀释倍数计算样品中的含量。
2 结果与讨论
2.1 色谱条件优化
参考GB 5009.265—2021《食品安全国家标准 食品中多环芳烃的测定》色谱条件,根据相似相容原理,采用HP-5 ms (30 m×0.25 mm,0.25 µm)色谱柱,色谱柱起始温度为50 ℃,比溶剂正己烷的沸点68 ℃低约20 ℃,样品在进样口处以一定的速度气化,大量溶剂带着目标组分快速流向低温柱头,并在柱头冷凝。冷凝在柱头上的溶剂与固定相膜混合形成比固定相膜厚几倍的溶剂液膜,溶剂液膜在色谱柱入口附近最厚,同时设置较快的升温速率(20 ℃/min),溶剂挥发速度较快,分析物组分就会浓缩在未挥发的溶剂中,利用溶剂聚焦效应确保不分流进样时16种多环芳烃均有良好的分离效果并得到尖锐的色谱峰形。16种多环芳烃化合物总离子流色谱图如图1所示。
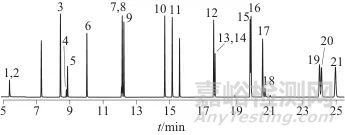
16种多环芳烃及5种内标混合标准溶液总离子流色谱图
Fig. 1 Total ion chromatogram of 16 polycyclic aromatic hydrocarbons and 5 internal standard mixed standard solutions
1—萘-d8(内标1); 2—萘; 3—苊烯; 4—苊烯-d10(内标2); 5—苊;6—芴; 7—菲-d10(内标3); 8—菲; 9—蒽; 10—荧蒽; 11—芘;12—苯并[a]蒽; 13—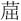 -d12(内标4); 14—
-d12(内标4); 14—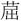 ; 15—苯并[b]荧蒽;16—苯并[k]荧蒽; 17—苯并[a]芘; 18—苝-d12(内标5); 19—茚并[1,2,3-c,d]芘; 20—二苯并[a,h]蒽; 21—苯并[g,h,i]苝
; 15—苯并[b]荧蒽;16—苯并[k]荧蒽; 17—苯并[a]芘; 18—苝-d12(内标5); 19—茚并[1,2,3-c,d]芘; 20—二苯并[a,h]蒽; 21—苯并[g,h,i]苝
2.2 质谱条件优化
以正己烷为溶剂,将16种多环芳烃混合标准溶液和5种氘代多环芳烃混合标准溶液配制成质量浓度均为1 mg/L的混合标准溶液,按1.3仪器工作条件,质谱采集方式选择全扫描(SCAN)模式,得到混合标准溶液SCAN数据。对混合标准溶液SCAN数据进行定性分析,选择PAHs基峰的质量数作为母离子,设置母离子及相应产物离子,选择2个或2个以上离子对,创建产物离子扫描方法及批处理表,运行后得到不同电压下离子对扫描数据,设定好定量离子和定性离子对,软件自动优化碰撞能量,优化结果见表1。
2.3 提取方法优化
2.3.1 提取方法
PAHs提取方法主要有索氏提取法[12‒13],加速溶剂萃取法[14‒15]和超声波提取法[8‒9]。索氏提取法提取效率高,但是耗时长,提取剂用量大;加速溶剂萃取法,虽然效率高,但是压力和温度不易控制,特别是压力容易泄漏,需要定期更换关键部件。参考王征等[9]选择适用于大批量样品同时处理的超声波提取法。
2.3.2 提取溶剂
选择3份茶叶样品,分别加入100 μL 16种多环芳烃混合标准使用液,配制成加标质量分数均为50 µg/kg的茶叶样品,分别以正己烷、丙酮、正己烷-丙酮(体积比为1∶1)混合溶剂为提取溶剂,用量均为10 mL,在40 ℃提取10 min,测定16种多环芳烃的回收率,结果如图2所示。由图2可以看出,以正己烷-丙酮混合溶剂为提取溶剂时,16种多环芳烃回收率最大,故选择正己烷-丙酮(体积比为1∶1)混合溶剂为提取溶剂。
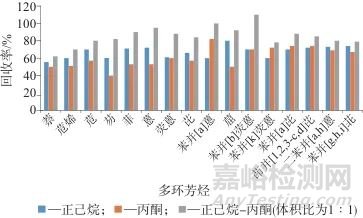
图2 不同提取溶剂时16种多环芳烃的回收率
Fig. 2 Recoveries of 16 polycyclic aromatic hydrocarbons with different extraction solvents
2.3.3 提取时间
在加标质量分数约为50 µg/kg的茶叶样品中,加入10 mL正己烷-丙酮(体积比为1∶1)混合溶液,提取温度为40 ℃,测定提取时间分别为5、10、30 min时16种多环芳烃的回收率,结果如图3所示。由图3可以看出,提取时间为5 min时,16种多环芳烃的回收率均较低,提取时间为10 min和30 min时,16种多环芳烃的回收率均较高,且相差不大。综合考虑,选择提取时间为10 min。
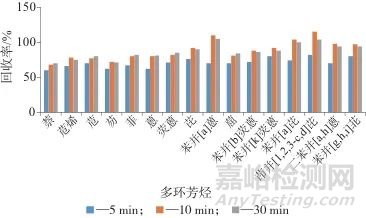
图3 不同提取时间时16种多环芳烃的回收率
Fig. 3 Recoveries of 16 polycyclic aromatic hydrocarbons at different extraction times
2.3.4 提取温度
在加标质量分数为50 µg/kg的茶叶样品中,加入10 mL正己烷-丙酮(体积比为1∶1)混合溶液,提取时间为10 min,测定提取温度分别为20、40、60 ℃时16种多环芳烃的回收率,结果如图4所示。
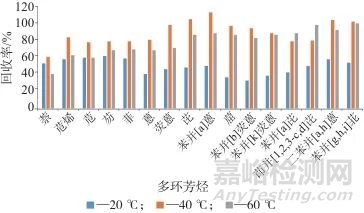
图4 不同提取温度时16种多环芳烃的回收率
Fig. 4 Recoveries of 16 polycyclic aromatic hydrocarbons at different extraction temperatures
由图4可以看出,当提取温度为20 ℃时,大多数化合物的提取率不到60%;当提取温度为40 ℃时,所有目标化合物的提取率均较高;而当提取温度为60 ℃时,二环和三环化合物的回收率明显下降了约10%~30%,综合考虑,选择提取温度为40 ℃。
2.4 净化方式优化
2.4.1 固相萃取柱选择
茶叶中含有大量色素,有脂溶性色素如叶绿素和类胡萝卜素,有水溶性色素如花黄素类和花青素类,还有加工过程形成的色素如茶黄素类和茶红素类等。不同色素极性差别较大,茶叶中多环芳烃净化的关键是去除色素。硅胶固相萃取柱[16‒17]、弗罗里硅净化柱[18‒19]和分子印迹固相萃取[20‒21]是多环芳烃常用的净化柱。茶叶样品经过硅胶固相萃取柱净化后样品溶液透明清亮,色素去除效果较好。弗罗里硅净化柱和分子印迹固相萃取柱几乎不能除去色素,净化液颜色很深,净化效果不理想,因此选择硅胶固相萃取柱净化。
2.4.2 固相萃取洗脱液选择
PAHs极性较弱,难溶于水,易溶于有机溶剂。洗脱液极性太小不利于极性大的目标化合物的洗脱;洗脱液极性太大,有可能将一些极性较大的杂质随同目标化合物一同洗脱下来,洗脱时需调整溶剂极性。正己烷属于非极性溶剂,适合洗脱非极性或弱极性PAHs,而二氯甲烷属于中等极性溶剂,适合洗脱中等极性的PAHs。单一溶剂对PAHs的溶解能力较差,不能有效地溶解样品中的污染物,为提高PAHs的回收率,选择二氯甲烷-正己烷混合溶液进行洗脱。选择加标质量分数为50 µg/kg的茶叶样品提取液5份,考察二氯甲烷-正己烷体积比分别为1∶9、2∶8、3∶7、4∶6、5∶5时的净化效果,结果如图5所示。
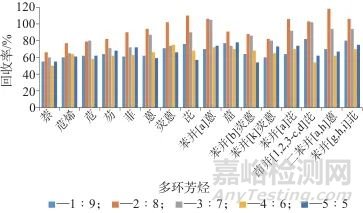
图5 二氯甲烷-正己烷不同体积比时16种多环芳烃的回收率
Fig. 5 Recoveries of 16 polycyclic aromatic hydrocarbons with different volume ratios of dichloromethane-n-hexane
由图5可以看出,当二氯甲烷-正己烷体积比为2∶8时洗脱效果最好,样品加标回收率为73.5%~116%,因此选择二氯甲烷-正己烷(体积比为2∶8)混合溶液作为洗脱液。
2.5 线性方程与检出限
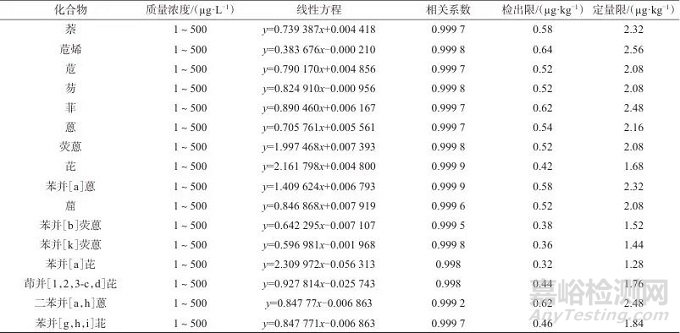
按照1.3仪器工作条件,对16种多环芳烃系列混合标准溶液从低浓度到高浓度依次进样分析,以各目标化合物的质量浓度为横坐标(x),以对应的色谱峰面积为纵坐标(y),绘制标准工作曲线,计算线性方程和相关系数。取7份石英砂,各2.00 g,分别加入16种多环芳烃混合标准使用液1 μL,按照1.4实验方法进行分析,获得7个平行样品中16种多环芳烃质量浓度,按照HJ 168—2020 《环境监测分析方法标准制订技术导则 附录A:方法特性指标确定方法》计算方法检出限和定量限,根据称样质量、定容体积及稀释倍数换算成样品中的含量,以质量分数(µg/kg)表示。16种多环芳烃的线性范围(质量浓度)、线性方程、相关系数、检出限及定量限见表2。由表2可知,16种多环芳烃化合物的质量浓度在1~500 µg/L范围内与色谱峰面积具有良好的线性,线性相关系数均不小于0.998,方法检出限为0.32 g~0.64 μg/kg,定量限为1.28~2.56 μg/kg。
表2 16种多环芳烃的线性范围(质量浓度)、线性方程、相关系数、检出限及定量限
Tab. 2 Linear ranges (mass concentration),linear equations,correlation coefficients,detection limits,and quantification limits of16 polycyclic aromatic hydrocarbons
2.6 样品加标回收与精密度试验
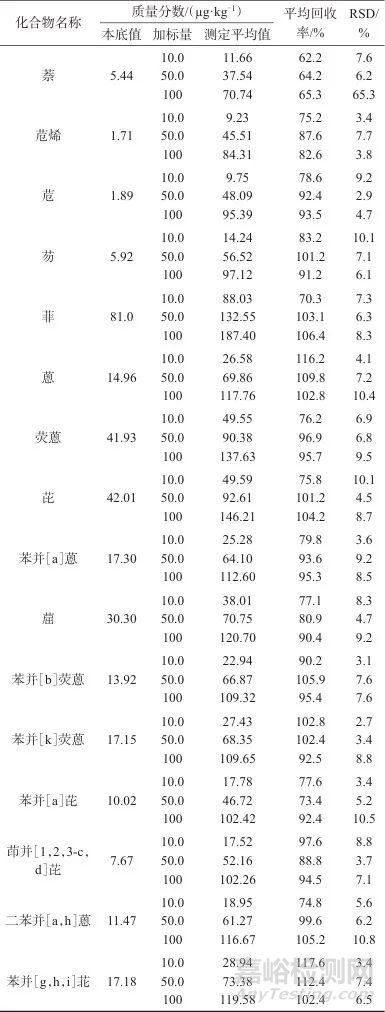
取茶叶样品,进行低(10 µg/kg)、中(50 µg/kg)、高(100 µg/kg) 3个水平的加标回收试验。按照1.4方法,每个加标水平平行制备6份加标样品溶液,在1.3仪器工作条件下平行测定,结果见表3。由表3可知,样品加标平均回收率分别为62.2%~117.6%,测定结果的相对标准偏差为2.7%~10.8%。其中萘的回收率平均为63.9%,低于其他目标化合物,萘作为二环芳烃的沸点217.9 ℃,比其他三环和四环芳烃化合物要低很多,属于挥发性有机物,在提取、净化和浓缩过程中损耗大。SN/T 4000—2014《出口食品中多环芳烃类污染物检测方法 气相色谱-质谱法》和HJ 805—2016《土壤和沉积物 多环芳烃的测定 气相色谱法-质谱法》中鱼、扇贝、熏肉、砂质土、耕作土、沉积物等不同基质中萘的回收率为40%~60%。依据GB/T 27404—2008 《实验室质量控制规范 食品理化检测》检测方法确认的技术要求,当被测组分质量分数小于0.1 mg/kg时,回收率为60%~120%,因此所建立的方法具有较高的准确度和良好的精密度,满足分析需要。
表3 样品加标回收与精密度试验结果(n=6)
Tab. 3 Results of samples spiked recovery and precision test(n=6)
3 结论
(1) 建立了超声破碎提取-硅胶净化-气相色谱-三重四级杆质谱法测定茶叶中16种多环芳烃,利用超声波破碎法对样品进行提取,方法简单、快速,适合大批量样品的处理。
(2) 硅胶净化柱价格低廉,通过调整洗脱溶剂的极性,可以实现PAHs的选择性分离,便于将PAHs与其他干扰物质分开,去除茶叶色素效果显著,是降低基质干扰的重要控制手段。
(3) 三重四级杆质谱采用多反应监测模式,进一步降低样品基质干扰,方法回收率和精密度良好,分析结果可靠稳定。
(4) 目前该方法还缺少对大量不同茶叶样品进行检测,特别是选择代表性的样品对所建立的方法进行验证,使该方法能更好地适用于各类茶叶中多环芳烃的检测,进一步降低检测成本。
参考文献
1 颜婷,葛天嗣,黄才欢,等.多环芳烃的形成、危害及其减控技术研究进展[J].食品科学,2024,45(14): 257.
YAN Ting,GE Tiansi,HUANG Caihuan,et al. Research progress on polycyclic aromatic hydrocarbons:formation,deleterious effects and control technologies[J]. Food Science,2024,45(14): 257.
2 刘文青,赵小宁,孙巍,等.多环芳烃控制策略及在中草药中污染情况分析[J].中成药,2024,46(3): 913.
LIU Wenqing,ZHAO Xiaoning,SUN Wei,et al. Polycyclic aromatic hydrocarbons control strategy and pollution analysis in traditional Chinese medicine[J]. Chinese Traditional Patent Medicine,2024,46(3): 913.
3 欧阳鹏武,王玮,李法云,等.道路雨水径流多环芳烃污染现状及其降解技术研究进展[J].应用化工,2024,53(2): 489.
OUYANG Pengwu,WANG Wei,LI Fayun,et al. Research progress of pollution status and degradation technology of PAHs in road stormwater runoff[J]. Applied Chemical Industry,2024,53(2): 489.
4 罗汉,张强,岳平,等.藏东南大气中多环芳烃的污染特征及来源分析[J].大气科学,2023,47(3): 853.
LUO Han,ZHANG Qiang,YUE Ping,et al. Pollution characteristics and source analysis of polycyclic aromatic hydrocarbons in the atmosphere of southeast Tibet[J]. Chinese Journal of Atmospheric Sciences,2023,47(3): 853.
5 高贯威,陈红平,刘平香,等.茶叶中多环芳烃污染水平及来源研究进展[J].热带作物学报,2016,37(10): 2 032.
GAO Guanwei,CHEN Hongping,LIU Pingxiang,et al. Contaminated levels and source of polycyclic aromatic hydrocarbons in tea[J]. Chinese Joumal of Tropical Crops,2016,37(10): 2 032.
6 宋卿,杨婷.高效液相色谱法测定滇山茶油中16种多环芳烃[J].当代化工,2022,51(2): 501.
SONG Qing,YANG Ting. Determination of 16 kinds of polycyclic aromatic hydrocarbons(PAHs) in camellia oil from Yunnan by high performance liquid chromatography[J]. Contemporary Chemical Industry,2022,51(2): 501.
7 黄肇章,王超,齐炜红,等.超声提取-在线固相萃取浓缩/液相色谱法测定大气颗粒物中超痕量多环芳烃[J].分析测试学报,2021,40(7): 1 025.
HUANG Zhaozhang,WANG Chao,QI Weihong,et al. Determination on ultra-trace of polycyclic aromatic hydrocarbons in atmospheric particulate matters by liquid chromatography coupled with ultrasonic extraction and online solid phase extraction concentration[J]. Journal of Instrumental Analysis,2021,40(7): 1 025.
8 郝晓红,史福霞,肖湾,等.气相色谱-质谱法测定书写笔用橡塑材料中18种多环芳烃的含量[J].理化检验-化学分册,2022,58(1): 7.
HAO Xiaohong,SHI Fuxia,XIAO Wan,et al. GC-MS determination of 18 polycyclic aromatic hydrocarbons in rubber-pastic materials of writing pens[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2022,58(1): 7.
9 王征,徐清,詹重清,等.气相色谱-三重四极杆串联质谱法同时测定茶叶中16种多环芳烃[J].食品安全质量检测学报,2021,12(19): 7 585.
WANG Zheng,XU Qing,ZHAN Chongqing,et al. Simultaneous determination of 16 kinds of polycyclic aromatic hydrocarbons in tea by gas chromatography-triple quadrupole tandem mass spectrometry[J]. Journal of Food Safety and Quality,2021,12(19): 7 585.
10 许丹丹,饶竹,梁汉东.气相色谱-质谱法同时测定地下水中36种多环芳烃及其衍生物[J].理化检验-化学分册,2019,55(1): 31.
XU Dandan,RAO Zhu,LIANG Handong,et al. Simultaneous determination of 36 kinds of polycyclic aromatic hydrocarbons and their derivatives in groundwater by gas chromatography-mass spectrometry[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2019,55(1): 31.
11 李创,潘扬昌,韦英亮.气相色谱-质谱法测定灌溉水中16种痕量多环芳烃[J].化学分析计量,2023,32(12): 23.
LI Chuang,PAN Yangchang,WEI Yingliang. Determination of 16 trace polycyclic aromatic hydrocarbons in irrigation water by gas chromatography-mass spectrometry[J]. Chemical Analysis and Meterage,2023,32(12): 23..
12 李盛安,冯敏铃,张定煌,等.全自动索氏提取-气相色谱三重四极杆串联质谱法测定土壤中18种多环芳烃[J].绿色科技,2018(22): 23.
LI Sheng′an,FENG Minling,ZHANG Dinghuang,et al. Determination of 18 polycyclic aromatic hydrocarbons in soil by triple quadrupole tandem mass spectrometry method with automatic soxhlet extraction and gas chromatography[J]. Journal of Green Science and Technology,2018(22): 23.
13 杨锐明.索氏提取结合固相萃取-气相色谱质谱法测定固定污染源飞灰中多环芳烃类有机污染物[J].分析仪器,2023,21(3): 20.
YANG Ruiming. Determination of polycyclic aromatic hydrocarbons in fixed source fly ash by SE with SPE and GC-MS[J]. Analytical Instrumentation,2023,21(3): 20.
14 袁小雪,江阳,杨长晓.等.快速溶剂提取-高效液相色谱法测定PM2.5中16种多环芳烃[J].分析化学,2017,45(11): 1 641.
YUAN Xiaoxue,JIANG Yang,YANG Changxiao,et al. Determination of 16 kinds of polycyclic aromatic hydrocarbons in atmospheric fine particles by accelerated solvent extraction coupled with high performance liquid chromatography[J]. Chinese Journal of Analytical Chemistry,2017,45(11): 1 641.
15 牛少敏,张鑫,田渭花,等.加速溶剂萃取-硅胶柱净化-气相色谱-三重四极杆质谱法测定环境空气气态和颗粒态样品中20种卤代多环芳烃[J].冶金分析,2024,44(1): 35.
NIU Shaomin,ZHANG Xin,TIAN Weihua,et al. Determination of 20 halogenated polycyclic aromatic hydrocarbonsin gaseous and particulate samples of ambient air by gas chromatography-triple quadrupole mass spectrometry with accelerated solvent extraction and silica gel column purification[J]. Metallurgical Analysis,2024,44(1): 35.
16 侯美玲,冯桂蓉,蔡小钦,等.高效液相色谱-内标法测定香辛料中15种多环芳烃类污染物(PAHs)[J].现代食品科技,2024,40(4): 331.
HOU Meiling,FENG Guirong,CAI Xiaoqin,et al. Determination of 15 polycyclic aromatic hydrocarbon(PAHs) pollutants in spices by an internal standard high performance liquid chromatography(HPLC)[J]. Modern Food Science and Technology,2024,40(4): 331.
17 包奋强,安海龙,惠亚梅,等.硅胶柱与凝胶柱净化/气相色谱-质谱联用测定植物叶片中多环芳烃[J].分析测试学报,2016,35(9): 1 185.
BAO Fenqiang,AN Hailong,HUI Yamei,et al. Determination of polycyclic aromatic hydrocarbons(PAHs) in plant leaf samples by silica gel column and cel column purification/gas chromatography-mass spectrometry[J]. Journal of Instrumental Analysis,2016,35(9): 1 185.
18 张天琪,李圣增,张厚勇,等.高效溶剂萃取-固相萃取/气相色谱-质谱法测定大气颗粒物中多环芳烃和有机磷阻燃剂[J].分析测试学报,2022,41(11): 1 600.
ZHANG Tianqi,LI Shengzeng,ZHANG Houyong,et al. Determination of PAHs and OPFRs in atmospheric particulate matters by high performance solvent extraction-solid phase extraction/gas chromatography-mass spectrometry[J]. Journal of Instrumental Analysis,2022,41(11): 1 600.
19 张俊华,胡越,张兵,等.弗罗里硅土柱固相萃取-气相色谱质谱法测定茶叶中的多环芳烃[J].海峡预防医学杂志,2024,30(3): 44.
ZHANG Junhua,HU Yue,ZHANG Bing,et al. Determination of polycyclic aromatic hydrocarbons in tea by florisilcolumn solid-phase extraction-gas chromatography-mass spectrometry[J]. Strait Journal of Preventive Medicine,2024,30(3): 44.
20 鞠香,陈克云,李海霞,等.分子印迹固相萃取-同位素稀释气相色谱质谱法测定肉制品中16种欧盟优控多环芳烃[J].环境化学,2024,43(8): 2 864.
JU Xiang,CHEN Keyun,LI Haixia,et al. Determination of 16 European priority polycyclic aromatic hydrocarbons in meat products by the molecularly imprinted solid phase extraction-isotope dilution-gas chromatography-mass spectrometry[J]. Environmental Chemistry,2024,43(8): 2 864.
21 刘丽娜,左甜甜,昝珂,等.分子印迹固相萃取-同位素内标-GC-MS/MS法测定种子果实类中药材中18种多环芳烃残留量及其初步风险评估[J].中国药学杂志,2024,59(8): 694.
LIU Lina,ZUO Tiantian,ZAN Ke,et al. Determination and preliminary risk assessment of 18 polycyclic aromatic hydrocarbons in seed-fruit herbs by molecular imprinting solid phase extraction combined with gas chromatography-mass spectrometry[J]. Chinese Pharmaceutical Journal,2024,59(8): 694.

来源:化学分析计量


