您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-06-15 22:03
01—什么是有源医疗器械的有效期验证?
有源医疗器械使用期限是指由医疗器械注册申请人/注册人通过风险管理保证产品安全有效使用的期限,在该期限内产品能够维持其适用范围。
02—为什么要做有效期验证?
2019年5月,《有源医疗器械使用期限注册技术审查指导原则》正式发布,为申报人员和审评人员提供了参考格式和关键信息等内容。不仅如此,指导原则也列出了相关的参考标准,以供申报和审评人员参考使用。2021年国家药品监督管理局发布第121号公告《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》,医疗器械注册申报资料要求及说明中指出“(七)、2.使用稳定性:如适用,应当提供使用稳定性/可靠性研究资料,证明在生产企业规定的使用期限/使用次数内,在正常使用、维护和校准(如适用)情况下,产品的性能功能满足使用要求。
03— 如何设计有效期验证方案?
1、适用范围
适用于有源医疗器械,既包括有源非植入类器械(医疗器械软件除外),也包括有源植入类医疗器械。
2、评价方式
一种为医疗器械注册申请人/注册人根据评价或经验预先设定使用期限,通过一种或多种方法进行验证证明预先设定值的合理性;一种为医疗器械注册申请人/注册人不预先设定期限值,通过一种或多种方法最终确定产品的使用期限。
3、评价路径
评价路径1为直接对产品进行验证。可以对该产品进行使用状态列举,完整分析出临床使用的情况,直接进行产品的实时老化试验或者加速老化试验等。试验时需参考临床使用频率和强度、使用环境的要求。
评价路径2为通过将产品(系统)分解为不同子系统/部件的方式进行评价。首先应详细分析分解关系,在此基础上通过不同的分解方式(如将产品分为关键部件及非关键部件和/或特征部件及非特征部件和/或可更换部件及不可更换部件和/或运动部件及非运动部件和/或电子部件及机械部件等)确定产品的使用期限。
有源医疗器械一般由多个部件组成,其中发挥重要作用,与产品预期用途息息相关的部件可作为关键部件。关键部件的使用期限一般影响整机的使用期限。在评估关键部件时,可能需要考虑以下方面内容:关键部件的安全有效性能(例如电介质强度、电阻、机械强度或电池电量等理化特性)是否会随时间退化?关键部件之间是否存在相互作用,导致实施预期功能的能力发生退化?不同生产制造过程或生产制造过程的改变是否对关键部件长期使用性能产生影响?
4、测试样品数量
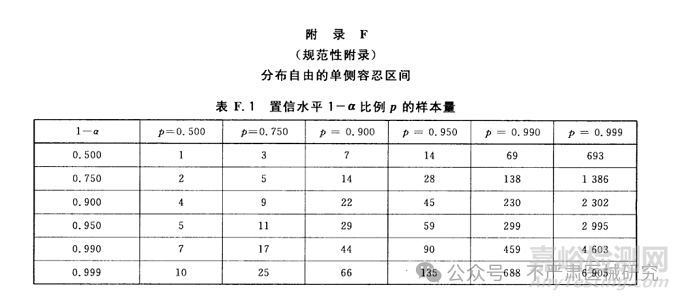
该表格提供了在不同置信水平 1−α和比例p 下,构建分布自由的单侧容忍区间所需的最小样本量。
行(置信水平 1−α):表示统计推断的置信度。例如,1−α=0.900 表示 90% 的置信水平。
列(比例 p):表示希望未来观测值落在单侧容忍区间内的概率。例如,p=0.900 表示要求 90% 的数据位于区间内。
表格中的数值:对应置信水平和比例p 下的最小样本量。例如:
当置信水平为 90%(1−α=0.900),且要求 90% 的数据在区间内(p=0.900)时,需要 22 个样本。
当置信水平和比例均要求极高(如 1−α=0.999,p=0.999)时,样本量高达 6,905。
注册用的有效期验证测试,为验证以一定置信水平保证总体中至少比例 p 的数据高于某个下限,所以基本设计成单侧容忍区间。根据申报产品的风险等级,样本量会有显著差异,基于企业实际情况,如低风险产品可能只需要满足置信水平0.90即可,高风险产品则需要达到0.95甚至0.99。
5、临床使用模式
该模式需要涵盖贮存模式(时间)、待机模式(时间)和工作模式(时间),在加速老化测试时,应对各状态进行加速(可以合并但更推荐串行测试)。
6、临床使用应力剖面
大多数产品临床使用应力主要侧重环境应力(如温度和湿度等)。
7、确认失效模型
根据产品特性选择物理模型,如Arrhenius模型。
8、确认加速时间

根据公式,分别得出3个状态下的加速老化时间。
9、确定功能测试项目
一般在加速前中后分别进行测试,项目包括电气安全如漏电流、接地电阻和电介质强度,以及产品主要/基本性能,已确认满足要求。
10、确认失效定义
当基本性能测试项目或基本安全测试项目中任意一项测试未通过时,判定整机失效。
11、结果判定
根据置信度和失效台数,计算产品平均使用期限下限,与标称使用期限进行比较,进行判定。

来源:不严肃医械研究


