您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-24 08:21
目的:描述和比较 2015 年 1 月 1 日—2020 年 12 月 31 日期间,美国加速审批与欧洲附条件批准的上市所附条件。
方法:通过美国和欧洲公开数据库,确定研究期间美国加速审批与欧洲附条件批准的所有药品的上市所附条件及上市后确证性临床研究。 结果:2015—2020 年,美国和欧洲分别有 122 和 35 个获 批事项通过加速审批 / 附条件批准上市。 美国 FDA 对每个获批事项平均提出了 1. 2 个上市所附条件,欧洲 EMA 平均提出了 2. 3 个,明显高于美国 FDA(P < 0. 001)。 美国上市所附条件的目的大部分是进一步确定 产品有效性(61.5%),而欧洲大部分是既要确定产品的有效性也要确定安全性(85.7%)。 美国和欧洲分别 对 54. 9% 和 61. 8% 的上市后确证性临床研究要求使用替代终点作为主要终点指标,对 95. 1% 和 88. 2% 的 上市后确证性临床研究要求使用干预,77.9%和61.8%的使用随机,63.1%和67.7%的使用对照。
美国上市后确证性临床研究报告提交时限平均为46.8个月,≥5年的占31.6%。 欧洲的平均时限为37.5个月,≥5年 的占21.9%。 结论:在上市所附条件方面,欧洲比美国更加谨慎和保守。 对于上市后确证性临床研究,美国 和欧洲的要求均以随机对照试验为主,但过多地应用了替代终点。 而对于上市后确证性临床研究的报告时 限,美国和欧洲大部分均在 5 年以内。 我国可充分借鉴美国和欧洲的经验教训,进一步完善我国的附条件批 准政策。
附条件批准因可以有效缩短产品上市时间而备受关注 。 为了满足患者临床急需,我国也积极颁布并实施了该政策。 附条件批准和其他加快上市注册程序最大的区别在于其允许药物在完成确 证性临床试验前基于替代终点、中间临床终点或早期临床试验数据提前上市,但是在获得附条件批准上市后,上市许可持有人需按照药品注册证书中所附的特定条件开展确证性临床试验,完成上市后要求。
2020 年 11 月,国家药品监督管理局药品审评中心颁布《药品附条件批准上市技术指导原则(试 行),对上市所附条件提出了要求,包括在说明书中明确药品为“附条件批准”、“申请人应与药品审评中心就上市后临床研究计划、研究完成日期、最终临床研究报告提交日期以及上市后风险管理计划 达成共识”等。 其中除了对确证性临床试验的要求 做了举例说明:“ 据替代终点和早期临床试验数据 而附条件批准上市的,应设计并完成以临床终点为 主要终点指标的确证性临床试验。 根据中间临床终 点而附条件批准上市的,应继续完成确证性临床试 验”,其他均为原则性要求,单凭文字很难做到深入地理解和执行。
我国研究者曾系统对比过中国附条件批准、美国加速审批和欧洲附条件批准的政策,发现其目的和核心要求基本类似:均是为了满足临床急需,允许 特定用途的医药产品在未获得确证性证据但可以满足监管机构相应的评价标准时提前上市,但是为了保证人民用药的安全性和有效性,监管机构会对申 办方提出批准其产品上市的条件,要求申办方在产 品上市后规定的时限内完成这些上市后研究或其他规定的条件。 美国和欧洲已有多年实施附条 件批准( 美国为加速审批) 的经验,并对外公 开了其全部审评文件,因此本研究拟通过研究美国 加速审批与欧洲附条件批准的上市所附条件,尤其是监管机构对确证性临床试验的要求,整理和归纳出其经验和特点,以期为我国附条件批准上市所附条件的提出和实施提供借鉴。
资料与方法
1 试验设计
通过美国和欧洲公开数据库确定 2015年1月1日—2020 年 12 月 31 日期间,加速审批 / 附条件批 准的所有药品及其上市所附条件和上市后确证性临 床研究,收集并分析比较其特征。
2 研究观察和分析单位
因为美国不仅允许创新药,还允许已上市药品通过加速审批改剂量、改剂型、增加适应证等,且美国和欧洲的一个上市申请中可以包含多个适应 证,一个适应证也可以对应不同的药品,因此本研究 将一份批文中获批的药品及其连带获批的某一具体 适应证结合起来作为观察和分析的单位,称为“获批事项” 。
3 数据来源和采集
本研究通过对比美国 FDA 网站药品评价与研究中心( Center for Drug Evaluation and Research,CDER) 药品和生物制品加速审批列表[15] (2021 年 6 月更 新) 和 2015—2020 年的 CDER 新药批准年报[16] 确 认美国 FDA 2015—2020年间全部加速审批的获批 事项。 通过在欧洲 EMA 网站上查询人用药品和生 物制品中,以附条件批准获批的欧洲公共评价报告 (European Public Assessment Report,EPAR) 并和 2015—2020 年的欧洲 EMA 年度报告 对比确认 欧洲 EMA 2015—2020 年间全部附条件批准的获批事项。
本研究通过美国 FDA 网站 Drugs@ FDA 数据库 和欧洲EMA 网站 EPAR 数据库[17] 中的产品批准信 和产品信息文件获得上市所附条件信息,包括上市 所附条件的个数和目的。 本研究中的上市所附条件 是指美国 FDA 和欧洲 EMA 针对加速审批和附条件 批准专门提出的,要求申办方在获批上市后实施的研 究活动。 在美国 FDA 的产品批准信里明确标识为 “ 加速 审 批 要 求 ( accelerated approval requirement ) ” , 在欧洲 EMA 产品信息文件内明确标识为“附条件 批准上市后需完成的特定条件( specific obligation to complete post⁃authorization measures for the conditional marketing authorization) ” ,不包含上市后主动安全监 测和企业承诺要做的其他上市后研究等。
本研究在上市所附条件中为每一个获批事项选择了一个上市后确证性临床研究,即支持将加速审 批 / 附条件批准转为完全批准的最重要上市后研究。 研究者根据审评文件中的描述,包括获益风险评估、 有效性和安全性审评、上市后要求等确定上市后确 证性临床研究,并根据上市所附条件的文字描述判 定监管机构对上市后确证性临床研究的主要终点指 标、研究设计(干预、随机、对照、盲法、样本量)、研究报告提交时间的要求。
4 质量控制
为保证数据采集质量,2 名研究人员平行进行 原始信息采集,并将 2 份采集的原始信息进行比对 和一致化。 后续由主要研究者根据研究方案中的指 标定义和标准对原始信息进行编码。 对于判定、分 类不清的问题,由研究小组开会讨论确定。 数据采 集表格填写完成后,随机抽取 10% 进行质量检查, 对有疑问的地方,在讨论后针对发现的问题对数据采集表格进行整体修改。 本研究采用 Epidata 3. 1 建库,由 2 名研究人员分别独立录入。 数据录入后 进行数据比对,并对不一致的地方进行复查和修改, 直至录入结果完全一致。 随后对数据的完整性、准 确性和逻辑性进行审核查验,对缺失、超出正常值范 围和存在逻辑矛盾的数据进行核对,完成数据清理 后锁定数据库并进行分析。
5 统计分析方法
采用频数( 百分比) 描述分类资料的分布特征。采用均数 ± 标准差或中位数( 四分位数间距) 描述 数值型资料的分布特征。 采用 χ2 检验或 Fisher 精 确检验对分类资料进行两组间比较,采用两样本 t 检验和非参数的 Wilcoxon 秩和检验对数值型资料 进行两组间比较。
以上统计学检验均采取双侧 alpha = 0. 05 作为 显著性水准。 所有的统计分析应用 SAS 9. 4 软件进行分析。
结果
2015年1 月1 日—2020 年12 月31 日,美国 FDA 通过加速审批路径共计批准了 115 项申请,包 含 122 个获批事项,涉及 59 个产品;欧洲 EMA 在此 期间通过附条件批准路径共计批准了 35 项申请,包 含 35 个获批事项,涉及 35 个产品。
1 监管机构提出的上市所附条件
美国 FDA 对 122 个获批事项提出了 143 个上 市所附条件,平均 1. 2 个 / 获批事项( 最少 1 个,最多 4 个),其中对 49 个创新药对应的获批事项提出了 65个上市所附条件,平均1.3个·获批事项-1(最少 1个,最多4个)。欧洲EMA对35个获批事项提出 了 80 个上市所附条件,平均为 2. 3 个·获批事项 - 1 ( 最少 1 个,最多 6 个) 。 欧洲附条件批准上市所附 条件个数明显高于美国(P <0. 001)。
美国上市所附条件的目的大部分是进一步确定 产品的有效性(61. 5% ),而欧洲大部分是既要确定 产品的有效性也要确定安全性(85. 7% )。 另外欧 洲有3个(8.6%)上市所附条件的目的是在上市后 补充生产工艺数据。 其他上市所附条件的目的,美 国包括确定药品的相互作用、剂量优化和确定剂量, 欧洲包括确定药品保质期、基因组学对疗效的影响 和活性物质特征。 美国与欧洲的上市所附条件个数 及目的见表 1。

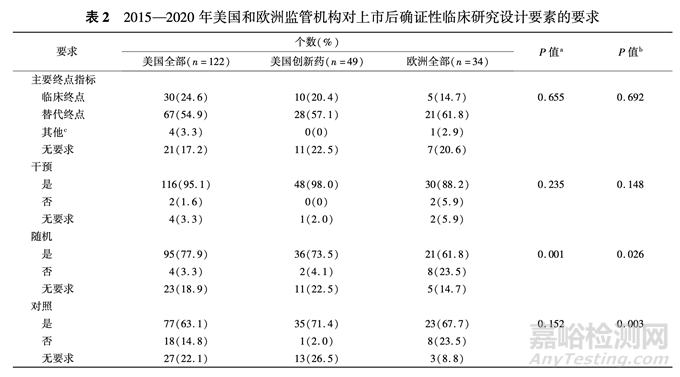
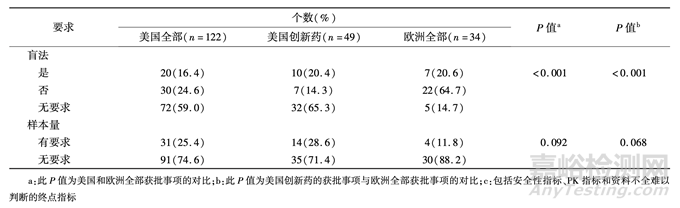
2 监管机构要求的上市后确证性临床研究本研究中,除欧洲有 1 个获批事项的批文未要 求开展上市后研究之外(EMEA/H/C/004554/0000, Ervebo,适用于 18 岁及以上高危人群的主动免疫, 以预防扎伊尔埃博拉病毒引起的埃博拉病毒病,上 市所附特定条件均为补充生产工艺数据),其他的 均对上市后研究提出了要求。 按照本研究定义,为 美国的 122 个获批事项和欧洲的 34 个获批事项分别 筛选了 122 个和 34 个上市后确证性临床研究,并根据审评文件中的文字描述研究了监管机构的要求。 美国和欧洲对大部分(美国 82.8%,欧洲 79. 4% )的上市后确证性临床研究均明确要求了使 用的主要终点指标,但其中仅有 24. 6% (美国)和 14.7%(欧洲)要求使用临床终点。 美国和欧洲分别要求 95. 1% 和 88. 2% 的上市后确证性临床研究使用 干预,77. 9% 和 61. 8% 的使用随机,63. 1% 和 67. 7% 的使用对照,16. 4% 和 20. 6% 的使用盲法,对 25. 4% 和 11. 8% 要求了样本量。 在对样本量有要求的获 批事项中,美国和欧洲均包含对样本量的定量要求, 如“至少124名直结肠癌患者”、“大约200人”、“至 少 25 个儿童”等;也包含定性要求,如“能代表某肿 瘤类型的足够数量患者” 等。
美国和欧洲分别对 18. 9% 和 14. 7% 的上市后 确证性临床研究未提出是否随机的要求,对 22. 1% 和 8. 8% 的未提出是否设置对照的要求,对 59. 0% 和 14. 7% 的未提出是否使用盲法的要求。 美国和 欧洲监管机构对上市后确证性临床研究设计要素的 要求见表 2。
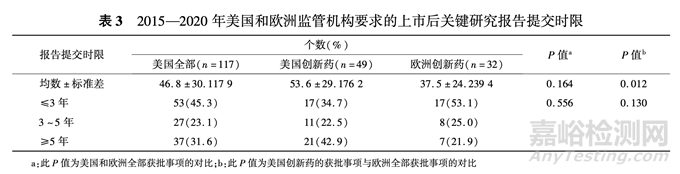
美国对 119 个(97. 5% ) 上市后确证性临床研究 要求了研究报告提交时间,其中有 117 个(95. 9% ) 的 时间晚于加速审批时间,上市后研究报告提交时限 平均为 46. 8 个月(最短 1 个月,最长 169 个月),≥5 年的占 31. 6% 。 其中,美国创新药的上市后确证性 临床研究报告提交时限平均为 53. 6 个月(最短 6 个月,最长117个月),≥5年的占42.9%。 欧洲对32 个(94. 1% )上市后确证性临床研究要求了研究报 告提交时间,平均时限为 37. 5 个月( 最短 1 个月,最 长 88 个月,明显短于美国创新药),≥5 年的占 21.9%。 美国和欧洲监管机构要求的上市后关键研 究报告提交时限见表 3。
讨论
本研究对 2015—2020 年美国加速审批和欧洲 附条件批准获批事项的上市所附条件和上市后确证性临床研究进行了分析比较,主要发现如下:
欧洲比美国要求了更多数量的上市所附条件; 美国上市所附条件的目的大多是确定产品的有效性,而欧洲是同时确定产品的有效性和安全性。 这 些差别和既往研究一致 ,均反映了欧洲更加谨慎和保守的审评态度。
其次,不管是美国 FDA 还是欧洲 EMA,其审评文件对上市所附条件的描述都没有统一的模板,不同审评文件的描述侧重点不同。 且这些描述均较为 粗略,无法通过这些简单的描述来确定上市后研究 的特点。 如美国和欧洲均有相当比例的上市 所附条件未对上市后确证性临床研究是否需要使用随机、对照和盲法做出明确要求。 专家也质疑这样 简单的描述会给予申办方在试验设计上太多的灵活性,导致上市后研究无法回答医生和患者最为关切 的问题。 因此,研究者建议各国监管机构制定上 市所附条件要求描述的模板,确定必须包含的要求 要素,如试验设计中的干预随机对照盲法、研究人 群、时间要求等,如果申办方和监管机构在加速审 批 / 附条件批准时已经确定了上市后关键研究,建议 将其 NCT 编号( national clinical trial number) 或试验 编号明确标出,以便公众查询和追踪其研究进程。
另外,本研究发现美国和欧洲要求的上市后确证性临床研究大部分是使用了替代终点的随机对照 试验。 替代终点的使用可以有效缩短试验时长、减 少样本量、降低试验花费,从而尽快满足患者 未被满足的医疗需求。 实践证明,一些基于替代终 点获批的药物已经为患者提供了有临床意义的治疗,改变了疾病的治疗方法,甚至将一些严重或危及 生命的疾病转为了慢性病 ,因此替代终点的使 用不仅受到申办方的欢迎,也得到监管机构的鼓励。
美国 FDA 为了更好地对替代终点进行研究,支持申办方合理地使用替代终点,开展了“生物标记物验证项目”,并在其网站上每半年更新一次“替 代终点指标列表” 。 根据替代终点对临床获益的 预测能力,美国 FDA将其分为 3 类:
1. 已知的可以 预测临床获益的替代终点,即已被验证的替代终点, 可用于常规审批,如血清中 HIV 抗体作为替代终 点用于 HIV 药物研发、血清钾作为替代终点用于 低钾血症药物的研发等。
2 “ 有理由认为可能” 预测产品临床获益的替代终点,可以用来支持加速审 批,如血清高铁血红蛋白作为替代终点用于高铁血红蛋白血症药物研发、痰培养转阴作为替代终点用 于活动性肺结核药物的研发等。
3 候选替代终点 指标,指还在验证其预测临床获益能力的过程中替 代指标。 但是美国 FDA 在其替代终点指标列 表中并未标注一个替代终点是经过验证的还是“ 有 理由认为可能” 预测临床获益的,而是标注了替代 终点适用的批准类型,同一个替代终点既可以支持 常规审批,也可以支持加速审批,需要根据“ 疾病具 体情况、疗效大小、疗效持续时间、疗效的不确定性 和其他可用疗法等”综合判断。 这一现象在肿瘤 领域尤为突出,如客观缓解率( objective response rate, ORR)和无进展生存期(progression free survival,PFS) 既可以支持药品在非小细胞肺癌、结直肠癌、头颈癌 等适应证中的常规审批,也可以支持药品在这些适 应证中的加速审批。 针对每个药品的每个适应证, 替代终点适用的批准类型都要具体问题具体分 析,这给替代终点的实际使用带来了很多讨论空间和争议。
事实上,因为疾病和疗法的复杂性,即使是大家都公认的“ 有理由认为可能” 预测临床获益的替代 终点,甚至是已被用于支持常规审批的替代终点,其 显示的疗效可能也无法转化为临床获益[29 -34] 。 Chen 等[35] 的研究显示在 85 个凭借 ORR 获批的事项 中,只有 6 个最终确定了总生存期( overall survival, OS)的获益。 Johnson 等的研究也发现 80% 的采 用反应率(response rate,RR)获得加速审批的肿瘤 领域的获批事项,上市后关键研究均未获得成功。 2022 年4 月22 日,美国 FDA 召开 FDA 肿瘤药物 咨 询 委 员 会 ( Oncologic Drugs Advisory Committee,ODAC)集中讨论了磷脂酰肌醇⁃3 激酶(phosphati⁃ dylinositol 3⁃kinase,PI3K)抑制剂的问题,被讨论的 4 个 PI3K 抑制剂均凭借 ORR 显示的疗效获得了在淋 巴瘤上的加速审批,其上市后确证性临床研究均采 用了 PFS 作为主要终点指标( PFS 已被用于支持淋 巴瘤药物的常规审批),OS 作为次要终点指标。 然 而这 4 个上市后研究均显示在 PFS 存在优势或潜在 优势的情况下,OS 却出现了下降。 进一步的分析提 示,OS 的下降可能是 PI3K 抑制剂的毒性所致 。 这一案例充分说明了即使是已被用于支持常规审批 的替代终点,也可能因为无法有效评估产品的毒性 而导致最终无法预测临床获益。 另外研究发现,使用替代终点的试验比使用临床终点的试验更容易得 到阳性的结果和更大的效应值。 因此,有欧 美专家建议所有应用替代终点的获批事项,其上市 后确证性临床研究都应使用临床终点来确定产品疗 效,而这一建议已充分体现在我国《 药品附条 件批准上市技术指导原则(试行)》中。
最后,本研究发现美国和欧洲加速审批 / 附条件 批准要求的上市后确证性临床研究报告提交时限平 均为46.8 个月(约3.9 年)和37.5 个月(约3.1 年), 无统计学差异。 但是美国和欧洲加速审批 / 附条件 获批事项中分别有31.6%和21.9%的时限 >5 年, 美国加速审批中最长的时限达到了 169 个月(14 年)。 有研究报道申办方在获得加速审批/ 附条件 批准后往往就会失去开展上市后研究的动力, 如果监管机构给予申办方如此长的上市后验证时 间,申办方在该时限内完全可以收回药物研发的成本,就会更加失去开展上市后研究的动力,而同时允 许一个未确证有效性和安全性的药品在市如此长的 时间,也会为患者和社会带来不必要的风险。
通过以上的分析和讨论,本研究认为在上市所附条件方面,欧洲比美国更加谨慎和保守。 对于上市后确证性临床研究,美国和欧洲的要求均以随机 对照试验为主,但过多地应用了替代终点。 而对于 上市后确证性临床研究的报告时限,美国和欧洲大 部分均在 5 年以内。 我国尚处于附条件批准的实施 初期,可以充分借鉴美国和欧洲的经验和教训,加强 对附条件批准上市所附条件的监管,如进一步规范 上市所附条件的描述;对于基于替代终点获得附条 件批准的获批事项,确保其上市后确证性临床研究 使用临床终点来确定产品疗效;明确限制上市所附 条件的完成时限且不应过长。 应要求申办方在附条件批准授予之前就和药品审评中心确定好上市后研 究方案,甚至已启动上市后研究。

来源:Internet


