您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-26 21:15
摘 要 / Abstract
人乳头瘤病毒(HPV)的持续感染是诱发宫颈癌的主要原因,通过接种HPV疫苗,可有效降低HPV感染的风险,继而降低宫颈癌的患病概率。本文阐述了HPV的分型、分子流行病学研究以及国内已上市HPV疫苗情况,介绍了本公司自主研发的重组三价HPV疫苗及其技术创新性,并开展了免疫原性研究。结果表明,重组三价HPV疫苗可使小鼠和大鼠产生高滴度、持久性强的特异性中和抗体,并且免疫效果与默沙东公司研制的Gardasil疫苗相当。
Persistent human papillomavirus(HPV) infection is the main cause of cervical cancer induction. HPV vaccination effectively reduces the risk of HPV infection, thereby decreasing the probability of cervical cancer. This article describes HPV typing, molecular epidemiology, and the current market status of HPV in China. Additionally, it introduces the research and development and technological innovation of a recombinant trivalent HPV vaccine independently developed by our company.Immunogenicity research has been conducted, revealing that recombinant trivalent HPV vaccine can induce high-titer and long-lasting specific neutralizing antibodies in mice and rats. The immune effect is comparable to that of Gardasil, a vaccine developed by Merck.
关 键 词 / Key words
人乳头瘤病毒;分子流行病学;宫颈癌;疫苗;免疫原性
human papillomavirus; molecular epidemiology; cervical cancer; vaccine; immunogenicity
人乳头瘤病毒(human papillomavirus, HPV)是女性生殖道及皮肤黏膜常见病原体,其感染比较常见,80%以上女性一生中至少感染过1次HPV[1]。一项由世界卫生组织国际癌症研究机构(International Agency for Research on Cancer, IARC)主导的研究表明,世界范围内22个国家的1000例组织学确认的浸润性宫颈癌病例的HPV检测结果显示,99.7%的宫颈癌呈现HPV-DNA阳性,表明HPV是诱发宫颈癌的主要因素[2-4]。HPV感染宿主上皮细胞后,会使宿主基因组发生不稳定和不可逆的改变。研究证明,高危型HPV的E6和E7分别通过降解抑癌基因p53和p Rb来诱发宫颈癌[5-6]。病原生物学、流行病学等证据充分表明,宫颈癌是由高危型HPV的持续感染引起的[7]。目前已经确认,HPV可以引起宫颈癌、阴茎癌、外阴癌、阴道癌、肛门癌和口咽癌(食管癌)等恶性肿瘤[8-16]。
1、HPV分型
根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)的报告,HPV属于乳头瘤病毒科(Papillomaviridae)。乳头瘤病毒科已知有至少53个属,HPV主要分布在Alphapapilomavirus(共14个种,其中13个种含HPV)、Betapapilomavirus(共6个种,其中5个种含HPV)、Gammapapil omavirus(共27个种,均含HPV)、Mupapilomavirus(共3个种,均含HPV)和Nupapillomavirus(共1个种,含HPV)这5个属中[7]。目前已知的HPV有200多个型别,分属上述5个属中的40多个种。不同型别HPV的L1基因序列差异大于10%,而同一型别HPV的序列差异小于2%[17]。国际癌症研究机构专题工作组依据HPV致癌性的不同将其分为三类,即高危型、低危型和可疑高危型[18-19]。我国HPV检测的型别范围依据2015年11月26日原国家食品药品监督管理总局发布的《人乳头瘤病毒(HPV)核酸检测及基因分型、试剂技术审查指导原则》明确为:(1)高危型HPV:包括HPV 16、18、31、33、35、39、45、51、52、56、58、59和68,共13种基因型,具有确定的致癌性。高危型HPV主要属于HPV系谱分类的α属内的不同种(包括Alphapapillomavirus 5、Alphapapillomavirus 6、Alphapapillomavirus 7、Alphapapillomavirus 9),其中HPV16和HPV58属于Alphapapillomavirus 9,HPV18属于Alphapapillomavirus 7。高危型HPV的感染与宫颈癌及癌前病变的发生密切相关,此外还与肛门癌、阴道癌、口咽癌及癌前病变的发生密切相关。(2)低危型HPV:包括HPV6和HPV11,属于HPV α属的Alphapapillomavirus 10,无致癌性。HPV6和HPV11的感染与90%以上的尖锐湿疣和低级别鳞状上皮增生病变的发生密切相关。(3)可疑高危型HPV:HPV26、53、66、73和82,共5种基因型。
2、HPV的分子流行病学
宫颈癌是由高危型HPV的持续感染引起的。不同的HPV型别在世界各地的流行病学分布不同。根据人乳头瘤病毒资讯中心(HPV Information Centre)发布的最新调查报告,在全球范围内,宫颈癌患者中宫颈细胞学检测结果显示,前10位的HPV感染型别为:HPV16(55.2%)、HPV18(14.2%)、HPV45(5.0%)、HPV33(4.2%)、HPV58(3.9%)、HPV31(3.5%)、HPV52(3.5%)、HPV35(1.7%)、HPV39(1.5%)、HPV59(1.4%)[20]。在中国,宫颈癌患者中宫颈细胞学检测结果显示,前10位的HPV感染型别为:HPV16(59.5%)、HPV18 (9.6%)、HPV5 =8(8.2%)、HPV52(6.5%)、HPV33(3.5%)、HPV31(2.8%)、HPV59(2.6%)、HPV45(1.9%)、HPV39(1.5%)、HPV56(1.1%)[20]。
2023年,人乳头瘤病毒资讯中心最新的数据统计显示,在全球范围内宫颈细胞学检查正常的女性中,HPV感染率为29.8%。按洲统计,大洋洲最高,为66.7%;其次是非洲、美洲和欧洲,分别为39.2%、34.5%和27.2%,最低的是亚洲,为20.8%[20]。此外,有报告指出HPV感染主要通过性行为传播,其感染率高低主要取决于人群的年龄和性行为习惯。年轻的性活跃女性子宫颈部位HPV感染率最高,感染高峰年龄在20岁左右。我国女性存在第二个HPV感染高峰,在40~45岁[21]。在中国,宫颈细胞学检查正常的女性中,最常见的5个型别是HPV52(2.8%)、HPV16(2.7%)、HPV58(1.7%)、HPV33(1.1%)和HPV18(1.1%)[20]。
3、HPV疫苗国内上市情况
接种HPV疫苗是阻断HPV传播的最经济、有效的手段[22-23]。早期动物乳头瘤病毒模型(棉尾兔乳头瘤病毒)研究表明,以感染性病毒颗粒或者去除病毒DNA成分的病毒样颗粒(virus-like particle,VLP)免疫动物后,可以预防乳头瘤病毒的感染,为研制HPV疫苗的可行性提供了证据[24-26]。在20世纪90年代初期,制备了HPV的VLP,证明了重组HPV疫苗的技术可行性[27]。同时期,众多研究队伍致力于HPV疫苗的研制,其基本技术路线的原理均为通过DNA重组技术体外表达HPV主要衣壳蛋白L1,利用其自组装形成VLP的特性用作免疫原[28]。HPV L1形成的VLP可以使机体产生中和抗体,从而阻止病毒感染,实现对宫颈癌等HPV相关疾病的有效预防。目前认为,所有HPV疫苗诱导的保护性中和抗体均为L1蛋白的构象特异性抗体[29]。
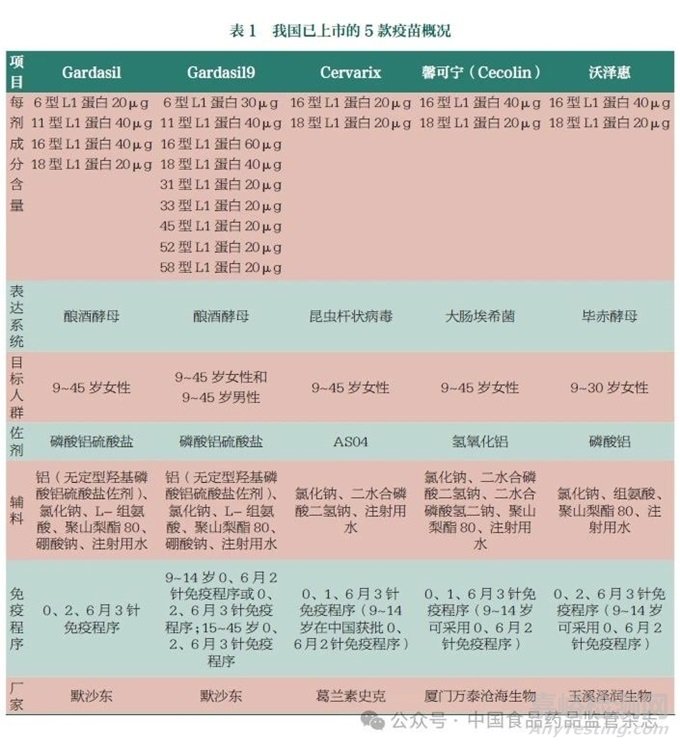
2006年,美国食品药品监督管理局(FDA)正式批准默沙东公司生产的Gardasil HPV预防性疫苗上市。它是由酿酒酵母表达并纯化的HPV6/11/16/18 L1VLP四价宫颈癌预防性疫苗。该疫苗被批准用于预防9~45岁女性HPV6、11、16、18感染所引起的宫颈癌、阴道癌、外阴癌和肛门癌及癌前病变和生殖器疣[30]。这是FDA批准的世界上第一个肿瘤疫苗。随后,英国葛兰素史克公司生产的商品名为Cervarix的HPV预防性疫苗也成功上市。它是来源于昆虫杆状病毒表达系统的HPV16/18L1 VLP二价宫颈癌预防性疫苗,使用AS04佐剂(氢氧化铝复合单磷酸脂质A),每0.5ml的二价疫苗中HPV16/18的L1蛋白含量为20μg。这些成分吸附于含500μg氢氧化铝和50μg 3-O-去酰基-4'-单磷酰脂质A的AS04佐剂系统中。该疫苗被批准用于9~45岁女性,预防HPV16、18病毒感染引起的宫颈癌、宫颈原位腺癌及癌前病变[31]。2014年,美国FDA批准默沙东公司生产的重组九价HPV疫苗Gardasil9(HPV6/11/16/18/31/33/45/52/58九价疫苗)上市,从而成为全球第三种已上市HPV疫苗。在我国,厦门大学联合厦门万泰沧海生物技术有限公司研发生产的二价HPV疫苗馨可宁(Cecolin)在2019年被批准上市。2022年,玉溪泽润生物技术有限公司生产的二价HPV疫苗沃泽惠也成功上市。3款进口疫苗价格昂贵且供应有限,满足不了全球疫苗接种的需求。馨可宁每剂售价约为Cervarix的一半,疗效却与Cervarix相似。馨可宁和沃泽惠对于9~14岁女性可采用2剂次接种。这2款国产疫苗的上市,很好地解决了进口疫苗价格昂贵且供应有限的问题,但这仍无法满足全球日益增长的疫苗接种需求。表1展示了我国已上市的5款疫苗概况。
4、重组三价HPV疫苗的研发及其创新性
目前全球HPV疫苗接种率仍不理想,远远低于世界卫生组织2030年“健康人群”的目标。因此需要加快疫苗的研发步伐,以满足全球疫苗接种的需求。本公司积极响应世界卫生大会通过的《加速消除作为公共卫生问题的宫颈癌全球战略》及提出的“90%的女童在15岁前全程接种HPV疫苗”目标,致力于重组HPV疫苗的研发。根据HPV流行病学数据,中国前3位的HPV致癌型别为:HPV16(59.5%)、H P V 1 8 (9.6%)、H P V 5 8(8.2%)[20]。本公司选择大肠埃希菌原核表达系统,以16、18、58型HPV病毒作为靶向病毒株,开发了重组三价人乳头瘤病毒(16/18/58型)疫苗(大肠杆菌)(以下简称重组三价HPV疫苗),用于预防HPV16、18、58感染和由此导致的宫颈癌等相关疾病,预防范围达77.3%,比已上市二价HPV疫苗预防范围增加了8.2%。本产品和已上市的疫苗技术路线基本相同,由单个HPV的主要衣壳蛋白L1,自动装配成VLP,其结构和天然HPV颗粒几乎没有差别,具有良好的免疫效果。用基因工程表达的L1蛋白直接装配出来的VLP大小、形态各异,稳定性较差,还需要对其进行纯化:先解聚得到五聚体,再重新组装成VLP。
HPV VLP疫苗工艺一般包括菌种库建立、菌种发酵、菌体收获、裂解、澄清纯化、层析纯化、VLP组装、换液、除菌过滤等步骤。目前,VLP疫苗纯化存在的问题主要有两个方面:一方面是可溶蛋白少(产量低)、易形成无规则的聚集体;另一方面是宿主内毒素和DNA残留高。因此,我们对L1基因序列进行了优化:(1)从结构入手,提高表达量,降低无规则聚集和蛋白降解。(2)从工艺优化入手,以结构为基础防止宿主内毒素和DNA被VLP包裹。研究发现:HPV L1 N端参与五聚体间相互作用,但N端截短不超过9个(含9个)氨基酸时,不影响HPV L1五聚体形成VLP(T=7);C端不超过30个氨基酸的截短亦不影响形成由72个五聚体组成的VLP(T=7)[32-33]。由于全长HPV L1蛋白不能或很难在大肠埃希菌中表达,采用N端截短的方式,可以提高大肠埃希菌表达系统表达HPV L1可溶性蛋白的表达量。采用C端截短的方式,可以减少L1蛋白降解,形成更多的、折叠正确的L1五聚体蛋白,减少多聚体的形成,使得L1蛋白在表达和纯化过程中主要以可溶性五聚体形式存在,进一步降低了纯化难度,有利于提高纯化收率和产量,均一的L1五聚体也保证了组装后VLP的均一度,从而获得高纯度、均一性好的VLP,显著改善了产品质量,有效解决了VLP纯化过程中纯度和收率低的问题,实现了VLP的高效率组装,为HPV VLP的研究提供了新的研发思路。
5、重组三价HPV疫苗免疫原性研究
HPV疫苗能够诱导特异性中和抗体,保护机体免受病毒侵害。因此,疫苗成功的关键是诱导有效的体液免疫,产生具有保护作用的中和抗体,对中和抗体的水平和持久性的研究是评估疫苗保护效果的重要依据[34]。
5.1 重组三价HPV疫苗在小鼠体内的免疫原性研究
针对本公司自制的重组三价HPV疫苗开展免疫原性研究,以默沙东公司生产的Gardasil疫苗为阳性对照,分别免疫小鼠,检测血清中的中和抗体滴度水平,检测结果如图1所示。
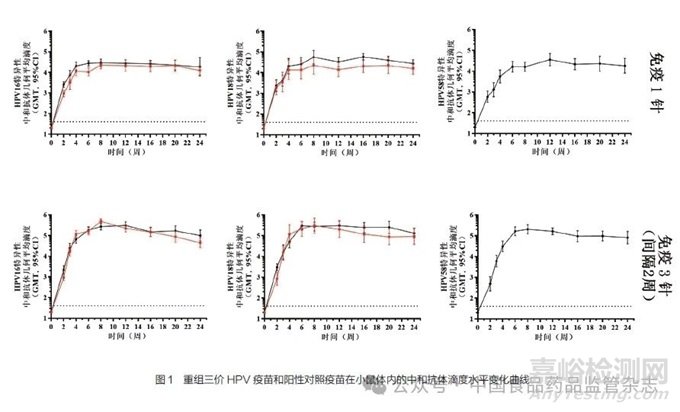
图1中,黑色实线为重组三价HPV疫苗免疫后的中和抗体滴度的动态变化,红色实线为相同剂量阳性对照疫苗Gardasil免疫后的中和抗体滴度水平变化曲线。图1中,中和抗体滴度以Log10表示,误差棒表示95%置信区间。
从图1可以看出,HPV16VLP产生的中和抗体滴度水平与阳性对照疫苗基本一致;HPV18VLP产生的中和抗体滴度水平略高于阳性对照疫苗;HPV58VLP产生的中和抗体在较高滴度水平。
5.2 重组三价HPV疫苗在大鼠体内的免疫原性研究
针对本公司自制的重组三价HPV疫苗开展免疫原性研究,以默沙东公司生产的Gardasil疫苗为阳性对照,测定了重组三价HPV疫苗在大鼠中的免疫原性,并观察了其免疫持久性(21周),检测结果如图2所示。
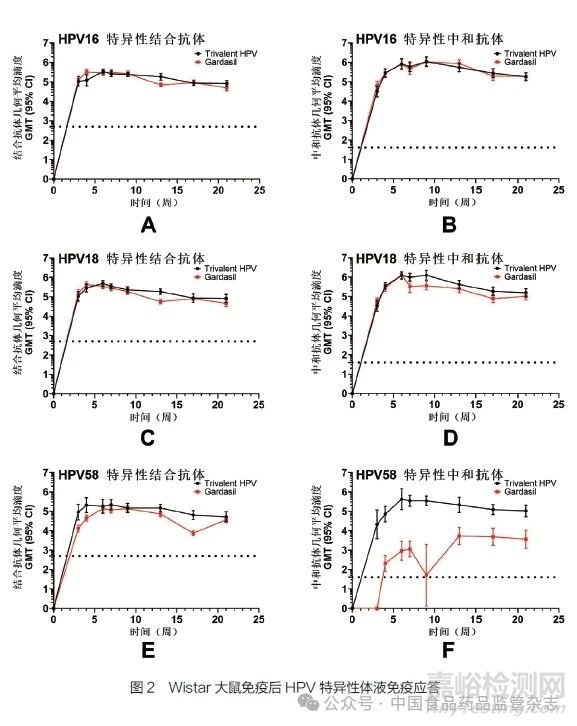
图2中,黑色实线表示重组三价HPV疫苗免疫大鼠后测定的结合/中和抗体滴度平均值;红色实线表示为阳性对照疫苗Gardasil免疫大鼠后测定的结合/中和抗体滴度平均值。图2中,结合/中和抗体滴度以Log10表示,误差棒表示95%置信区间。
从图2A、图2C可以看出,HPV16、18 VLP产生的结合抗体滴度水平与阳性对照疫苗基本一致;从图2E可以看出,HPV58 VLP产生的结合抗体滴度水平较高。从图2B、图2D、图2F可以看出,HPV16VLP产生的中和抗体滴度水平与阳性对照疫苗基本一致,HPV18VLP产生的中和抗体滴度水平略高于阳性对照疫苗,同时HPV58VLP产生了较高的中和抗体滴度。
图1和图2的结果表明,重组三价HPV疫苗可使小鼠和大鼠产生高滴度、持久性强的特异性中和抗体,且免疫效果与已上市疫苗相当。未来,该疫苗有望成为进口疫苗的有力竞争对手。
6、总结与展望
HPV感染引起的疾病一直是人类关注的焦点。世界卫生组织于2020年11月17日发布《加速消除宫颈癌全球战略》(Launch of the Global Strategy to Accelerate the Elimination of Cervical Cancer),全球194个国家承诺共同消除宫颈癌,以期到2030年,HPV疫苗接种覆盖率达90%、筛查覆盖率达70%以及宫颈癌前病变和宫颈癌治疗可及性达90%。HPV疫苗在预防宫颈癌方面发挥着非常重要的作用。在过去20年中,HPV疫苗研究快速发展,二价、四价和九价疫苗均已获得上市许可,有效预防了全球HPV感染。康乐卫士采用原核表达系统研发了多款HPV疫苗,包括重组三价HPV疫苗,重组九价HPV疫苗,以及覆盖全部高危型别的重组十五价HPV疫苗。这些HPV疫苗通过基因工程设计、生产工艺优化等方式提高了产量,从而大大降低生产成本,未来将在预防HPV感染方面发挥重要作用。相信在全体科研人员的努力下,人类将不再受HPV感染的困扰。
引用本文:
刘玉莹,陈晓,伍树明,银飞,刘永江*.人乳头瘤病毒疫苗的概况及重组三价人乳头瘤病毒疫苗的研发[J].中国食品药品监管,2023(12):85-91.

来源:中国食品药品监管杂志


